Разработан интерфейс для протезов ног, восстанавливающий естественную походку
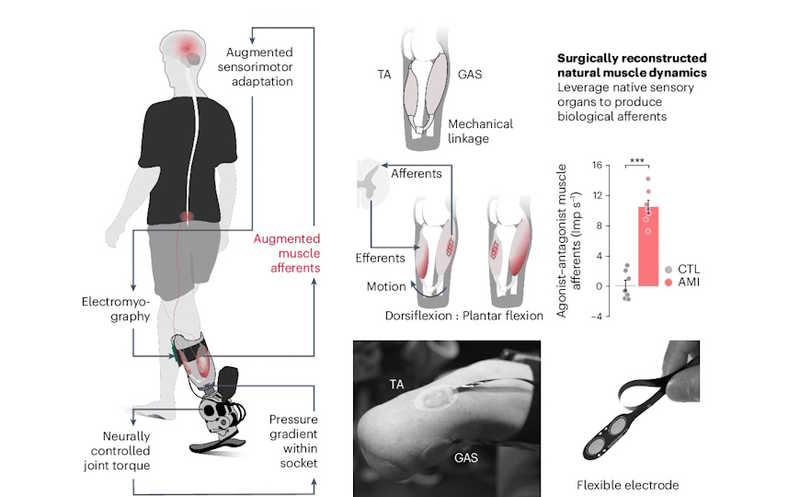
Существующие бионические протезы ног используют внутреннюю систему контроля, не связанную с нервной системой человека. Авторы статьи в Nature Medicine сообщают о подходе, который способен в значительной мере восстановить естественную механику ходьбы. При ампутации ноги создается нервно-мышечный интерфейс между остаточными мышцами — агонистом и антагонистом (AMI), а затем в управлении протезом участвуют электромиографические сигналы от этих мышц.
Nature Medicine. 2024. DOI: 10.1038/s41591-024-02994-9 | CC BY 4.0
Каждый шаг, который делает человек, — результат координации осознанных движений и спинальных рефлексов, непрерывного взаимодействия сигналов от афферентных (сенсорных) и эфферентных (двигательных) нейронов. Сигналы от мышечных рецепторов, то есть от афферентных нейронов, сообщают о положении ног в пространстве, и это крайне важно для естественной походки.
Бионическая нога, которая, подобно живой конечности, воспринимала бы сигналы от нейронов человека, пока остаются научной фантастикой. На нынешнем уровне развития медицины и технологий бионические ноги имеют роботизированное управление, позволяющее добиться биомиметического (имитирующего естественное) передвижения. Обычно используются подходы на основе конечного автомата и распознавания образов, которые переводят циклы движения ноги в дискретные состояния, определяемые фазой движения и типом местности. Внутренняя система контроля воспроизводит алгоритм походки с учетом информации от датчиков на протезе, без нейромодуляции (управления) со стороны пользователя.
Чтобы бионические конечности стали более похожими на человеческие ноги, например, могли бы ступать мягко или с высокой точностью поворачивать стопу при движении на любом рельефе, они должны полностью управляться нервной системой человека и не зависеть от контроллеров движения. Однако остаточный двигательный контроль у ампутантов нарушен из-за несогласованной работы мышц, неконтролируемого одновременного сокращения мышц-агонистов и антагонистов. Утрата значительной части мышц и нервов, в том числе периферических афферентных нейронов (мышечных афферентов) прерывает поступление «входящих» сигналов, позволяющих чувствовать и при необходимости корректировать положение ноги. Кроме того, оставшиеся после ампутации мышцы подворачивают, формируя мышечную прокладку для удобного использования протеза, что дополнительно нарушает их динамику и проприоцепцию (способность ощущать положение и движение).
Компенсировать отсутствие периферических афферентов можно с помощью электрической стимуляции нервов; этот подход в основном исследовался для создания нейропротезов рук. Однако в ходьбе более важную роль играют спинальные рефлексы, поэтому и роль биомиметических афферентов намного значительнее. Можно предположить, что усиление остаточной афферентной сигнализации в конечности пациента улучшит адаптацию нервной системы к протезу и будет способствовать лучшей нейромодуляции.
Цель клинического испытания NCT03913273, которое спонсирует Массачусетский технологический институт, — улучшение методов контроля нейропротезов и их функциональное тестирование у людей с ампутацией ноги ниже колена. Чтобы усилить остаточную активность мышц после ампутации, участникам формировали так называемый нервно-мышечный интерфейс между агонистом и антагонистом (agonist-antagonist myoneural interface, AMI). Две мышцы, агонист и антагонист, механически соединяли в ходе ампутации таким образом, чтобы при сокращении агониста растягивался антагонист, и наоборот, как это и происходит в целой конечности. (А именно, чтобы улучшить контроль голеностопного сустава протез,а латеральную часть икроножной мышцы соединяли с большеберцовой мышцей, для улучшения контроля подтаранного сустава длинную малоберцовую мышцу соединяли с задней большеберцовой.) Используя остаточные мышцы и сухожилия, AMI имитирует работу неповрежденных мышц и направляют в центральную нервную систему афферентные импульсы, аналогичные сигналам от полноценной конечности. Это помогает восстановить естественную проприоцепцию.
Исследование, описанное в Nature Medicine, было частью NCT03913273. Нейропротезы получили семеро пациентов в возрасте от 18 до 65 лет, перенесшие ампутацию ноги ниже колена с формированием AMI (группа AMI), уже использовавшие стандартные пассивные протезы и способные передвигаться в различном темпе. В группу контроля (CTL) включили семь человек, которым была проведена аналогичная ампутация, но без AMI. Все пациенты прошли два занятия по ходьбе общей продолжительностью около 6 часов и сообщили, что перемещаются уверенно.
В конструкцию нейропротеза входили искусственный голеностопный сустав с электроприводом и электромиографический (ЭМГ) сенсорный блок с гибкими электродами, прикрепляемыми на кожу. Для нейромодуляции движений голеностопного сустава на протяжении всего цикла шага — тыльного (дорсифлексия, DF) и подошвенного (плантарная флексия, PF) сгибания — разработали нейропротез-контроллер, на вход которого поступали электромиографические сигналы от икроножной и большеберцовой мышц. Важно, что не применялись заранее заданные алгоритмы ходьбы. Для управления стопой контроллер использовал данные о положении протеза в пространстве, скорости передвижения, а также ЭМГ-сигналы от мышц, с учетом справочных данных о максимальных показателях отношений «силы-длины» и «силы-скорости» мышц при естественных положениях лодыжки.
Чтобы оценить, как изменил AMI работу мышечных афферентов, авторы сравнивали нейромеханику икроножной и большеберцовой мышц во время максимального усилия при DF и PF у пациентов из обеих групп. Для этого рассчитывалась разница между антагонистическим (удлинение) и агонистическим (укорачивание) афферентами обеих мышц. AMI существенно увеличил этот показатель (10,5 ± 0,88 имп/с против 0,09 ± 0,69 имп/с в контрольной группе). Для здоровых мышц он составляет около 60 имп/с, то есть AMI позволяет достичь 18%-ной эффективности работы мышц по сравнению с нормой.
Участников попросили пройтись с самостоятельно выбранной максимальной скоростью, и оказалось, что пациенты из группы AMI выбирают более быстрый темп, чем контрольная группа (1,78 ± 0,04 и 1,26 ± 0,07 м/с соответственно). Таким образом, максимальная скорость передвижения выросла на 41% и приблизилась к результату здоровых людей (1,81 ± 0,03 м/с). Во время ходьбы по ровной поверхности с разными скоростями участники с AMI продемонстрировали более естественную кинематику движения. При увеличении скорости группа AMI увеличивала примерно втрое пиковую мощность работы бионической лодыжки, и чистую работу; иными словами, походка стала энергичнее.
Кинематическая симметрия нижних конечностей в AMI-группе была на 19–26 % выше, чем в СTL-группе, а при максимальной скорости ходьбы достигала 84,9 ± 1,3%, что составляет 93% от нормы для людей с полноценными конечностями.
На наклонной дорожке участники с AMI сохраняли механику ходьбы по ровной поверхности, увеличивая мощность и чистую работу при подъеме по сравнению со спуском. Они демонстрировали управляемую амортизацию в момент переноса центра тяжести при спуске по лестнице и дополнительное усилие в фазе подъема. Протезы с внутренней системой контроля не позволяют достичь таких результатов.
При перешагивании через препятствия (оценка взаимодействия между спинномозговыми рефлексами и осознанной двигательной реакцией) участники из группы AMI, но не из контрольной группы, продемонстрировали увеличение DF, как и здоровые люди.
Таким образом, создание AMI при ампутации ноги выше колена улучшает управление нейропротезом и адаптирует его к различным скоростям ходьбы, рельефу местности и т.п., несмотря на то, что AMI не в точности реконструирует динамику неповрежденных мышц. Исследователи считают, что их эксперименты демонстрируют возможности сенсомоторной адаптации: даже частичное восстановление передачи нервных импульсов позволяет усилить как спинномозговые рефлексы, так и контроль двигательных действий со стороны головного мозга.
На момент написания статьи процедура создания AMI была выполнена более чем 50 пациентам с ампутированными на разных уровнях ногами. Результаты этого исследования могут использоваться для создания протезов с нейронным контролем движений, чтобы достичь еще более полного восстановления функций, отмечают авторы.
Протезы ног с реалистичными тактильными ощущениями повысили мобильность пациентов
Источник
Hyungeun Song, et al. Continuous neural control of a bionic limb restores biomimetic gait after amputation // Nature Medicine. 01 July 2024. DOI: 10.1038/s41591-024-02994-9


 Меню
Меню





 Все темы
Все темы



 0
0