РНК-модифицирующим белкам коронавируса необходимо взаимодействие с ионом магния
Кэпирование РНК позволяет SARS-CoV-2 ускользать от иммунной системы. Работа вирусного белкового комплекса, метилирующего нуклеотиды кэпа, зависит от присутствия иона магния. Нарушения связывания с ионом приводит к утрате ферментативной функции комплекса.
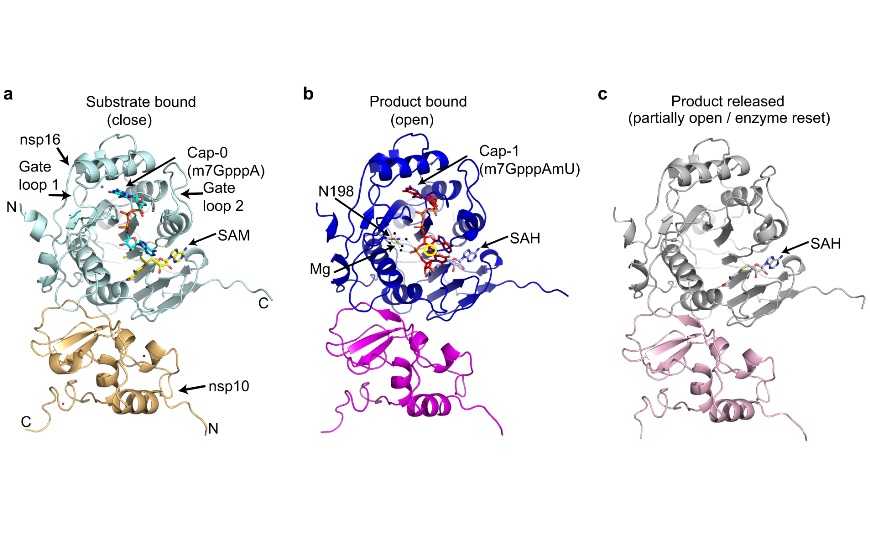
SARS-CoV-2, как и другие РНК-вирусы, использует РНК-кэпирование для более эффективной продукции белков, защиты РНК от деградации и ухода от иммунного ответа. У коронавирусов за финальную модификацию кэпа отвечают два белка, nsp16 и nsp10. Используя кофермент S-аденозилметионин, они метилируют 2′-OH группу первого транскрибируемого нуклеотида, обычно аденина. Считается, что такой кэп может связываться с компонентами иммунной системы хозяина и подавлять иммунный ответ.
Ученые из США определили кристаллические структуры двух вариантов гетеродимера nsp16/nsp10. Одна структура соответствует состоянию комплекса до выхода из него кэпа: с белками связаны метилированный кэп и следующий за ним нуклеотид, а также побочный продукт реакции, S-аденозилгомоцистеин. Вторая структура — это комплекс после высвобождения РНК. Он включает в себя только nsp16/nsp10 и S-аденозилгомоцистеин.
В предыдущей работе эта же команда определила структуру комплекса nsp16/nsp10 до метилирования, с двумя нуклеотидами без финальной метильной метки и коферментом. Этот результат использовали в качестве модели для разрешения структуры новых комплексов.
Оказалось, что в состоянии связывания с продуктом (метилированным кэпом) гетеродимер nsp16/nsp10 имеет увеличенный размер по сравнению с субстрат-связанным комплексом. В присутствии продукта метилированная группа первого нуклеотида как бы выталкивает побочный продукт наружу. На следующей стадии, только с побочным продуктом, конформационные изменения направлены на возвращение комплекса к исходной ориентации и подготовке к следующему раунду кэпирования.
Таким образом, белковый комплекс совершает движения, напоминающие дыхание. В субстрат-связанном состоянии он полностью закрыт, с продуктом — открыт, а в присутствии побочного продукта открыт частично. И кэп, и побочный продукт находятся в одном и том же глубоком и удлиненном кармане nsp16. Неметилированный кэп стабилизируется множеством электростатических взаимодействий с аминокислотными остатками. Метилированный продукт связан с ними слабее, остатки аминокислот в такой структуре отодвигаются дальше от кэпа.
Исследователи считают, что такое увеличение объема комплекса может приводить к диссоциации nsp10, который стимулирует ферментативную активность nsp16.
В зоне взаимодействий белка и следующего за кэпом нуклеотида, урацила, авторы работы обнаружили необычную электронную плотность, которая могла соответствовать иону металла, взаимодействующему с молекулами воды. Модель, в которую был включен Mg2+, оказалась наиболее статистически вероятной. Взаимодействие с ионом магния важно как для обеспечения эффективного метилирования 2′-OH группы аденина, так и для предотвращения модифицирования урацила.
Замена на аланин аминокислотных остатков, взаимодействующих с Mg2+, приводила к полному отсутствию ферментативной активности комплекса. Мутация в магний-взаимодействующей белковой цепи, найденная в новых штаммах SARS-CoV-2, уменьшала активность комплекса на 80%. С другой стороны, замена в этой же позиции положительного заряженного аргинина на более короткий аспарагин приводила к повышенной на 30% ферментативной активности.
Доктор Йогеш Гупта, руководитель работы, доцент биохимии и структурной биологии Центра наук о здоровье Техасского университета, добавляет: «Следующий шаг — использование этих структурных знаний для разработки новых методов лечения COVID-19 и возникающих коронавирусных инфекций. Мы уже изучаем, каким образом дисбаланс в концентрациях металлов регулирует иммунный ответ хозяина на эти инфекции».
Источник
Viswanathan, T.M., et al. // A metal ion orients SARS-CoV-2 mRNA to ensure accurate 2′-O methylation of its first nucleotide. // Nature Communications, 2021; DOI: 10.1038/s41467-021-23594-y


 Меню
Меню





 Все темы
Все темы




 0
0








