Сенсор на основе бактериофагов определяет возбудителя инфекции мочевыводящих путей
Наличие симптомов и положительного бактериального посева — золотой стандарт в диагностике инфекций мочевыводящих путей. Тем не менее, культивирование бактерий занимает до 30 часов. Исследователи из Швейцарии и США адаптировали фаговую диагностику для идентификации самых распространенных патогенов. При заражении целевой бактерии экспрессируется репортерный ген нанолюциферазы. Чувствительность технологии составила всего 68–87%, а селективность — 99%.
Причиной возникновения инфекций мочевыводящих путей может быть множество микроорганизмов, от бактерий до грибков. Чаще всего инфекцию вызывают бактерии Escherichia coli, Klebsiella spp. или Enterococcus faecalis. Очень важно быстро и точно идентифицировать патоген для назначения эффективной терапии. Это позволяет ограничить применение антибиотиков широкого спектра действия. Золотой стандарт диагностики инфекций мочевыводящих путей — это наличие симптомов и положительный бактериологический посев. Точность диагностики можно улучшить при помощи масс-спектрометрии и (или) секвенирования 16 рРНК. Однако метод посева занимает от 18 до 30 часов. Высокая длительность получения результатов приводит к тому, что антибиотики чаще назначают эмпирически. Это, в свою очередь, усугубляет распространение антибиотикорезистентности. Были разработаны новые, более быстрые методы, но ни один полностью не удовлетворяет всем требованиям, предъявляемым диагностическим тестам.
Команда ученых из Швейцарии и США предложила использовать бактериофаги для определения патогена, вызывающего инфекции мочевыводящих путей. По задумке, после попадания в образец мочи бактериофаг заражает специфичную для него бактерию и экспрессирует репортерный белок. В качестве репортерного белка ученые взяли нанолюциферазу. Таким образом, наличие и тип патогена можно определить по свечению образца.
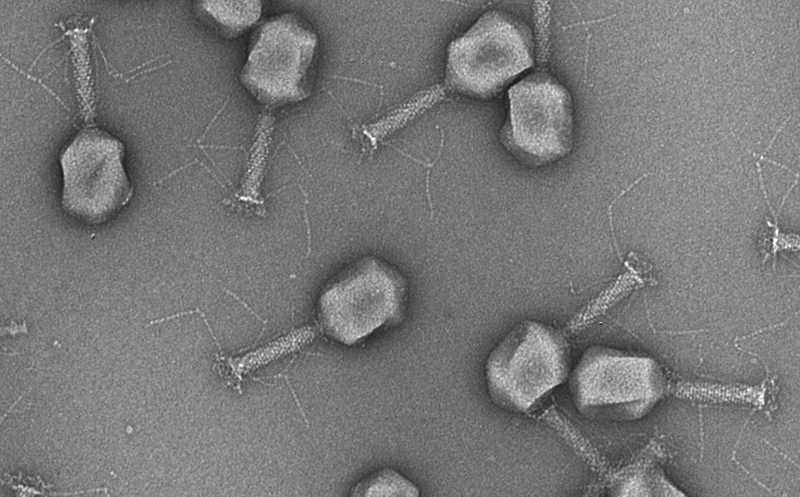
Сначала ученые собрали 663 изолята уропатогенов, ставших причиной инфекции мочевыводящих путей или бессимптомной бактериурии. Они идентифицировали 30 бактериальных видов и подтвердили, что E. coli, Enterococcus spp. и Klebsiella spp. встречаются чаще всего. Затем они отобрали бактериофаги из сточных вод и провели многоступенчатый процесс селекции. В результате авторы получили по паре специфических фагов для E. coli, Klebsiella spp. и Enterococcus spp. Затем они секвенировали отобранные вирусы, получили их изображения на криоэлектронном микроскопе и выявили бактерии, которые могут поражать фаги. На основе этих вирусов с помощью технологии CRISPR-Cas были созданы репортерные фаги, экспрессирующие ген нанолюциферазы при поражении целевых бактерий.
Исследователи проверили вирусы на бактериальных культурах, полученных из клинических образцов. Они продемонстрировали, что морфология фаговых бляшек у модифицированных бактериофагов не изменилась. Дополнительно ученые показали, что их сенсор помогает обнаружить патоген вне зависимости от наличия антибиотикорезистентности у бактериальной клетки, хотя интенсивность биолюминесценции варьирует в широких пределах.
Авторы проверили свой метод диагностики на клинических образцах мочи (всего 206 образцов). Чувствительность теста оказалась в пределах от 68% (для E. coli) до 87% (для Klebsiella spp.). В отличие от чувствительности, селективность диагностики была очень высокая и достигала 99% для каждого вида бактерии. В общей сложности для диагностики исследователи потратили пять часов, при этом один час ушел на дополнительный рост бактерий.
Таким образом, авторы надеются, что их разработка поможет ускорить определение патогенов и выступит в роли оперативного способа диагностики в отсутствие специальных лабораторий.
Источник:
Meile S., et al. Engineered reporter phages for detection of Escherichia coli, Enterococcus, and Klebsiella in urine. // Nature Communication. 2023. DOI: 10.1038/s41467-023-39863-x


 Меню
Меню





 Все темы
Все темы




 0
0