Синтетические антибиотики лечат смертельные «плотоядные» инфекции
Новый класс антибиотиков — ГмПциды (GmPcides) — поможет решить проблему антибиотикорезистентности грамположительных патогенных бактерий. Авторы препринта на bioRxiv сообщают об экспериментах по излечению инфекций пиогенным стрептококком у мышей с помощью ГмПцида, способного разрушать бактериальную биопленку и подавлять выработку бактериальных токсинов.
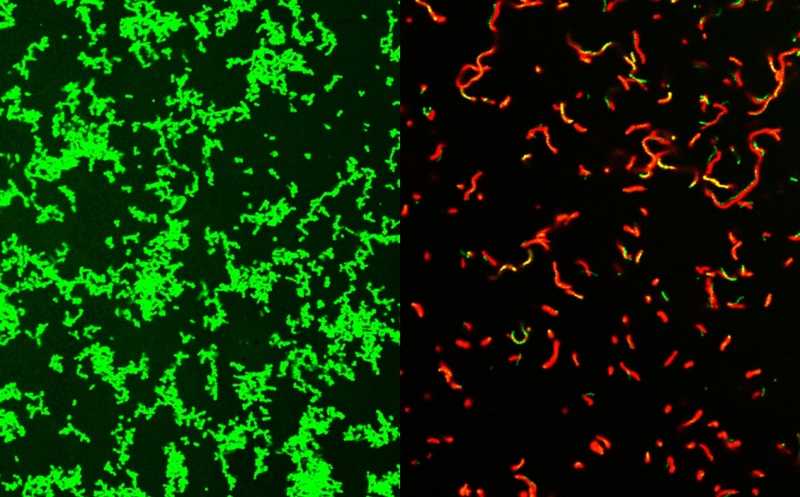
Культура Streptococcus pyogenes, необработанная ГмПцидом (слева) и убитая культура после обработки (справа).
Credit:
Zongsen Zou, Washington University, St Louis | Пресс-релиз
Сегодня существует острая необходимость в разработке новых антибиотиков против бактерий, обладающих множественной лекарственной устойчивостью (МЛУ). Команда ученых из Медицинской школы Университета Вашингтона в Сент-Луисе (США) и Университета Умео (Швеция) разработала новый класс синтетических антибиотиков и продемонстрировала их эффективность против смертельных «плотоядных» инфекций на мышиных моделях.
ГмПциды (GmPcides, от gram-positive-icide) появились в результате поисков препарата, который бы предотвращал образование бактериальных биопленок на поверхности уретральных катетеров, что часто приводит к инфекциям мочевыводящих путей. Внимание ученых привлекли пептидомиметики на основе 2-пиридона. Пептидомиметики — соединения небелковой природы, содержащие такие же функциональные фрагменты, как и пептиды, которые они имитируют, и обладающие почти такой же биологической активностью, но более устойчивые к внешним воздействиям. Оказалось, что производные 2-пиридона не только препятствовуют образованию биопленок, но и обладают бактериостатической и бактерицидной активностью.
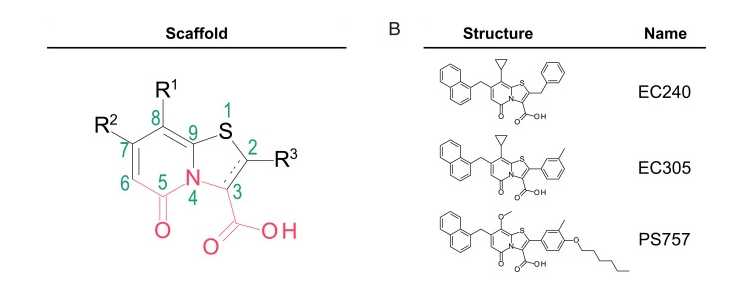 2-пиридон (слева) и его производные. Credit: PNAS 2022. DOI:
10.1073/pnas.2210912119 |
CC BY-NC-ND 4.0
2-пиридон (слева) и его производные. Credit: PNAS 2022. DOI:
10.1073/pnas.2210912119 |
CC BY-NC-ND 4.0
Для экспериментов ученые выбрали ГмПцид PS757 — вещество, обладающее бактериостатической и бактерицидной активностью против широкого спектра грамположительных бактерий с МЛУ, в том числе против ванкомицинрезистентного Enterococcus faecalis (VRE), метициллинрезистентного Staphylococcus aureus (MRSA), мультирезистентного Streptococcus pneumoniae, клиндамицинрезистентного Streptococcus agalactiae и эритромицинрезистентного Streptococcus pyogenes. Все эти патогены входят в Список приоритетных бактериальных патогенов, опубликованный ВОЗ в 2024 году.
Ранее было показана эффективность PS757 in vitro, в настоящем же исследовании препарат проверяли на мышиной модели с некротизирующей инфекцией кожи и мягких тканей (ИКМТ), вызванной S. pyogenes — грамположительной бактерией, которая вызывает более чем 500 тысяч смертей ежегодно и по этому показателю приближается к ротавирусу и кори. Пиогенный стрептококк вызывает широкий спектр заболеваний, таких как стрептококковая ангина, скарлатина, синдром токсического шока, острый гломерулонефрит, ревматизм, а также ИКМТ от импетиго до некротизирующего фасциита. Последний по-английски называют «плотоядной болезнью» (flesh-eating disease).
S. pyogenes пока еще чувствителен к антибиотикам, в том числе и к бета-лактамам, но 90 % штаммов могут образовывать биопленку и благодаря этому противостоять действию антибиотиков, переходя в разряд рецидивирующих инфекций. Кроме того, S. pyogenes продуцирует токсины — гемолизины, разрушающие мембрану эритроцитов, активаторы плазминогена, адгезины, фиксирующие бактериальную клетку на слизистой организма-хозяина, а также белки, влияющие на систему комплемента, специфические и неспецифические протеазы и другие ферменты с разрушительным для клеток и тканей действием. Основная стратегия борьбы с пиогенным стрептококком — подавление экспрессии токсинов (клиндамицин) и угнетение размножения бактерий (бета-лактамы). При этом клиндамицин все чаще оказывается неэффективным из-за растущей резистентности бактерий, вызывающих внутрибольничные инфекции.
Бактериостатическая активность (подавление роста и размножения бактерий) PS757 проявлялась при его минимальной ингибирующей концентрации (МИК) 0,78 мкМ. Бактерицидная активность (уничтожение бактерий) — при МИК 1,56 мкМ. Сублетальная концентрация (подавление основных жизненных функций) составила 0,4 мкМ.
Бактерицидный эффект PS757 проявлялся и на экспоненциальной, и на стационарной фазах ростах популяции S. pyogenes. Обработка клеток стрептококка PS757 в сублетальной или бактерицидной концентрации повреждала нуклеоид бактерий, как и антибиотики, вызывающие конденсацию и фрагментацию ДНК у золотистого стафилококка S. aureus. В бактерицидной концентрации GmPcide PS757 повреждает клеточную стенку бактерий, причем на ней образуются многочисленные «пузыри», похожие на те, что возникают в клеточных оболочках Escherichia coli после обработки грамицидином S. Исследователи предполагают, что PS757 ингибирует пути, задействованных в репликации ДНК, биосинтезе клеточной стенки или продукции специфических белков.
Эксперименты на мышах с ИКМТ показали, что подкожное введение PS757 подавляет экспрессию генов, кодирующих основные факторы вирулентности пиогенного стрептококка: М-белок, обеспечивающий его устойчивость к врожденным и адаптивным иммунным реакциям, и пирогенный экзотоксин (цистеиновую протеазу SpeB). В результате уменьшается повреждение тканей, снижается бактериальная нагрузка и ускоряется заживление ран.
Наконец, ГмПциды — один из немногих видов антибиотиков, которые могут уничтожать неделящиеся бактериальные клетки. PS757 был эффективен на всех стадиях образования биопленки S. pyogenes: он предотвращал ее формирование на начальном этапе, созревание, а также уничтожал зрелую биопленку.
Исследователи уверены, что ГмПциды можно использовать в профилактике и лечении ИКМТ, вызванных пиогенным стрептококком. К этим препаратам восприимчивы и другие грамположительные бактерии, в том числе энтерококки и стафилококки. Ученые надеются, что резистентность к ГмПцидам появится нескоро, так как пока слишком мало бактериальных клеток способно пережить терапию.
Из ранее не культивируемой бактерии выделен новый антибиотик
Источник
Zou Z., et al. Dihydrothiazolo ring-fused 2-pyridone antimicrobial compounds treat Streptococcus pyogenes skin and soft tissue infection // bioRxiv [Preprint]. 2024. Jan 3:2024.01.02.573960. DOI: 10.1101/2024.01.02.573960


 Меню
Меню





 Все темы
Все темы




 0
0







