Стимуляция аутофагии может защитить от болезни Гентингтона
Ученые из США показали на нейронах, перепрограммированных из фибробластов, что в развитии болезни Гентингтона важную роль играет регуляция аутофагии. Они обнаружили механизм, подавляющий аутофагию в нейронах при старении и позволяющий болезни прогрессировать. Исследование открывает путь к возможным методам терапии этого смертельного заболевания.
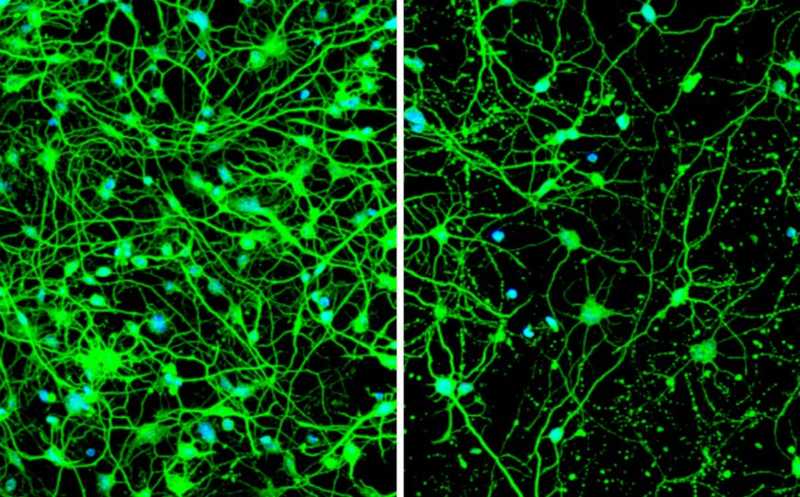
Слева показаны нейроны, трансформированные из клеток кожи молодого пациента с пресимптоматической болезнью Гентингтона. Справа нейроны, трансформированные из клеток кожи пожилого пациента с симптомами; в них нарушена аутофагия, что приводит к гибели клеток.
Credit:
Youngmi Oh, Seongwon Lee | Пресс-релиз
Болезнь Гентингтона — смертельное генетическое нейродегенеративное заболевание, проявляющееся с возрастом. Из-за постепенного разрушения наиболее чувствительных к заболеванию отделов мозга у носителя появляются и нарастают проблемы с контролем движений, а затем с поведением и мышлением. Механизмы, которые связывают начало болезни со старением, на сегодняшний день мало изучены. Исследователи из медицинской школы Университета Вашингтона в Сент-Луисе выяснили, от каких особенностей регуляции генов зависят вариации картины заболевания у людей одного возраста и со сходным генетическим статусом.
Причина болезни Гентингтона — мутация в гене белка гентингтина (далее HTT) и последующее накопление в наиболее уязвимых подтипах нейронов дефектной формы белка. HTT становится токсичным из-за увеличения числа повторов кодона CAG в полиглутаминовом тракте. До 36 глутаминовых остатков подряд безопасны, но дальше вероятность проявления болезни начинает расти: чем больше повторов, тем раньше появятся симптомы.
Число повторов не единственный фактор, влияющий на скорость развития болезни. Большинство пациентов имеют 40–50 повторов, а первые симптомы возникают в 35–45 лет, при этом картина течения болезни может сильно варьировать. Целью нового исследования был поиск других связанных с возрастом внутренних причин болезни и предложение возможных методов терапии.
Ученые взяли фибробласты у четырех групп доноров различных возрастов: носители болезни Гентингтона с симптомами, бессимптомные носители и две здоровые контрольные группы, одна молодого возраста, другая — пожилого. При помощи нейрональной микроРНК miR-9/9* и miR-124 фибробласты были перепрограммированы в проекционные шипиковые нейроны (MSN) полосатого тела — подтип нейронов, наиболее уязвимый к мутантному HTT. Такой способ получения нужных нейронов, в отличие от использования стволовых клеток, позволил сохранить эпигенетическую информацию о старении. Сохранение информации подтверждается тем, что нейроны от пациентов с симптомами гибли значительно чаще, чем полученные от еще здоровых носителей, хотя обе группы нейронов синтезировали мутантный HTT.
Для выявления особенностей, способствующих устойчивости к патогенному HTT, сразу после завершения перепрограммирования клеток был получен транскриптом каждой группы нейронов. Гены разбили на модули методом WGCNA, а затем внутри каждого модуля выделили функциональные группы генов по методам GSEA. Таким образом был определен модуль, изменения транскрипции в котором наиболее вероятно связаны с фенотипом нейронов, подверженных дегенерации. Он содержал гены, ассоциированные с апоптозом, аутофагией, фолдингом белка. Методом Omni-ATAC-seq была оценена доступность хроматина для транскрипции и выявлены отличия, связанные с развитием симптомов у пациентов. У генов-кандидатов проанализировали регуляторные последовательности.
В результате было определено ключевое для исследования взаимодействие— подавление экспрессии гена белка STAT3, участвующего в регуляции аутофагии, избытком микроРНК miR-29b-3p, которая связывалась с его 3’-нетранслируемым участком.
Химической стимуляцией аутофагии, ингибированием miR-29b-3p и сверхэкспрессией STAT3 авторы подтвердили, что это взаимодействие вносит важный вклад в выраженность нейродегенеративных процессов у пациентов одного возраста: все три вмешательства снижали гибель нейронов в культуре.
Интересно, что это уникальное для человека взаимодействие, не подтвержденное для мышей, из чего авторы работы делают вывод о важности моделирования наследственных заболеваний на человеческих клетках.
До какого-то возраста дефектная форма HTT, склонная к агрегации, удаляется из клетки за счет аутофагии сгустков белка. У человека нарастающий дефицит STAT3 приводит к изменению транскриптома и последующему ослабеванию процессов аутофагии, из-за чего происходит накопление HTT и гибель клеток.
Показанная связь с падением экспрессии STAT3 открывает новые пути для исследований терапии болезни Гентингтона. За последние годы уже несколько потенциальных препаратов были отвергнуты по тем или иным причинам и не вышли на рынок, так что новое направление может оказаться перспективным.
Кроме того, болезнь Гентингтона — яркий пример заболевания, связанного со старением, поэтому исследование ее эпигенетики вносит вклад в исследование старения в целом как эпигенетического феномена.
Источник
Oh, Y. M., et al. Age-related Huntington’s disease progression modeled in directly reprogrammed patient-derived striatal neurons highlights impaired autophagy. // Nature Neuroscience (2022), published 27 October 2022. DOI 10.1038/s41593-022-01185-4


 Меню
Меню





 Все темы
Все темы



 0
0