Т-клетки в опухоли накапливают липиды вместо их утилизации и снижают свою активность
Ученые из США показали, что опухолевое микроокружение, которое конкурирует с опухоль-инфильтрирующими Т-лимфоцитами за питательные вещества, тормозит метаболизм Т-клеток. Оно заставляет их аккумулировать липиды вместо того, чтобы получать энергию за счет окисления жирных кислот. Это происходит из-за активации ацетил-КоА-карбоксилазы (ACC) — ее экспрессия в Т-лимфоцитах возрастает, приводя к синтезу и накоплению липидов вместо их утилизации. Ингибирование ACC в мышиной модели меланомы активировало Т-клетки и способствовало противоопухолевому иммунитету.
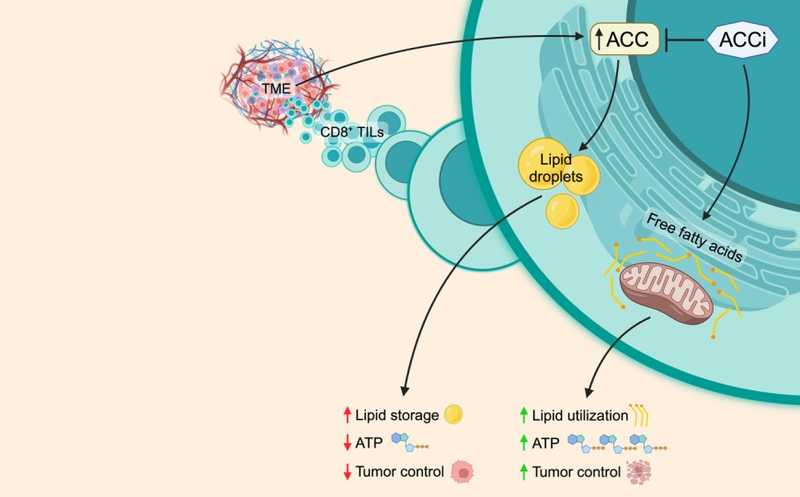
Активность ацетил-КоА-карбоксилазы стимулирует накопление липидов в Т-клетках и снижает их активность, тогда как ингибирование этого фермента стимулирует противоопухолевый иммунитет.
Credit:
Cell Metabolism, 2024. DOI:
10.1016/j.cmet.2024.02.009 |
CC BY
Микроокружение солидных опухолей способно подавлять функциональность опухоль-инфильтрирующих Т-клеток. Одна из причин этого состоит в том, что количество питательных ресурсов в опухоли ограничено, поэтому опухолевые и иммунные клетки вынуждены за них конкурировать. Ученые из США выяснили, что опухолевое микроокружение индуцирует активность ацетил-КоА-карбоксилазы в Т-клетках, заставляя их накапливать липиды вместо того, чтобы их метаболизировать.
Уже известно, что неэффективность Т-клеточного противоопухолевого иммунитета при солидных опухолях связана с подавлением метаболических функций Т-лимфоцитов. Исследователи выделили опухоль-инфильтрирующие CD8+ Т-лимфоциты из мышиной фибросаркомы и сравнили их с Т-клетками, выделенными из здоровой селезенки. По данным секвенирования РНК они провели анализ обогащения по функциональной принадлежности (GSEA) и выяснили, что в опухоль-инфильтрирующих лимфоцитах сильнее экспрессировались гены, связанные с аномальной циркуляцией липидов.
Предположив, что в опухоль-инфильтрирующих Т-клетках нарушен метаболизм липидов, ученые провели липидомику при помощи сверхпроизводительной жидкостной хроматографии в сочетании с тандемной масс-спектрометрией (UPLC-MS/MS). Общее содержание липидов в опухоль-инфильтрирующих Т-клетках было в 1,5 раза выше, чем в выделенных из селезенки. При этом возрастало количество большинства классов липидов: ди- и триацилглицеридов, фосфатидилхолинов, фосфатидилинозитолов и т.д.
Стеатоз — избыточное накопление липидов — чаще всего обусловлен ферментативной активностью ацетил-КоА-карбоксилаз (ACC) в отсутствие дополнительной утилизации липидов. ACC контролирует липогенез de novo, и авторы работы проверили, повышена ли ее экспрессия в опухоль-инфильтрирующих CD8+ Т-клетках. Анализ данных секвенирования РНК показал, что экспрессия одного из изоферментов — ACC1 (Acaca) — была значимо повышена в этих лимфоцитах, тогда как другого — ACC2 (Acacb) — снижена. Эти данные подтвердились и на образцах, полученных от пациентов с саркомой.
Когда ученые обрабатывали CD8+ Т-лимфоциты соединением ND-646 — аллостерическим ингибитором ACC1/2 — биосинтез липидов в этих клетках снижался. Аналогичные результаты давал нокаут Acaca с помощью CRISPR-Cas9. Таким образом, активность ацетил-КоА-карбоксилазы стимулирует липогенез в CD8+ Т-лимфоцитах. Ингибирование этого фермента стимулировало метаболизм в Т-клетках — метаболомные данные указали то, что в них индуцировалось окисление жирных кислот.
По существующим данным, при дефиците питательных веществ клетки ограничивают активность ACC, чтобы обеспечить переход от биосинтеза липидов к катаболизму жирных кислот. Однако опухоль-инфильтрирующие Т-клетки парадоксальным образом аккумулировали липидные капли. Экспрессия ACC1 в этих клетках, как уже было установлено, возрастала в таких условиях. Когда авторы работы измерили оценили скорость синтеза АТФ в митохондриях Т-лимфоцитов, подвергшихся воздействию опухолевого микроокружения, они обнаружили, что продукция АТФ в них снижалась. Этот эффект блокировался ингибированием ACC1 при помощи ND-646.
Наконец, исследователи продемонстрировали, что ингибиторы ACC1 способны усиливать противоопухолевое действие CD8+ Т-лимфоцитов. Они обрабатывали Т-лимфоциты ND-646 и проводили секвенирование РНК. Анализ вариаций наборов генов (gene set variation analysis, GSVA) показал, что в Т-клетках, обработанных ингибитором ACC, уменьшались признаки истощения по сравнению с контрольными. Анализ 18 фенотипических маркеров с помощью проточной цитометрии показал, что в присутствии ингибитора ACC Т-клетки меняли свой фенотип — они активировались и экспрессировали больше маркеров стволовости, таких как CD62L, TCF-1 и BCL-2.
Т-клетки с чертами стволовости обеспечивают более эффективное и длительное сдерживание роста опухоли, чем Т-клетки с эффекторным фенотипом. Ученые проверили на мышиной модели меланомы, скажется ли нокаут ACC1 в Т-лимфоцитах на противоопухолевом иммунитете. И действительно, ACC1-/- Т-клетки эффективнее сдерживали рост опухоли, чем контрольные Т-лимфоциты. На фенотип Т-лимфоцитов мышей повлияло и введение ингибитора ACC1 — ученые инъецировали ND-646 мышам с меланомой и через неделю анализировали опухоль-инфильтрирующие Т-клетки. Оказалось, что у мышей, получавших ND-646, в опухоли было примерно втрое больше жизнеспособных CD8+ Т-лимфоцитов, чем у контрольных животных. Кроме того, их Т-клетки активнее продуцировали цитокины.
Полученные данные свидетельствуют о том, что накопление липидных капель, регулируемое ацетил-КоА-карбоксилазой, служит фактором, вызывающим дисфункцию CD8+ Т-клеток в опухоли. Авторы работы предполагают, что воздействие на запасы липидов как в Т-клетках (например, CAR-T), так и в опухолевом микроокружении сможет повысить эффективность иммунотерапии опухолей.
Активация пролинового метаболизма CAR-T-клеток повышает их противораковую эффективность
Источник
Elizabeth G. Hunt, et al. Acetyl-CoA carboxylase obstructs CD8+ T cell lipid utilization in the tumor microenvironment. // Cell Metabolism, 2024. DOI: 10.1016/j.cmet.2024.02.009


 Меню
Меню





 Все темы
Все темы





 0
0