В микрофлоре кишечника найден метаболический путь леводопы
Ученые проанализировали метаболизм леводопы — лекарства, используемого при болезни Паркинсона, — в кишечнике человека и обнаружили межвидовой бактериальный путь ее метаболизма. Участие микрофлоры в метаболизме леводопы, вероятно, снижает эффективность ее применения и вызывает побочные действия, а также обуславливает большое их разнообразие.
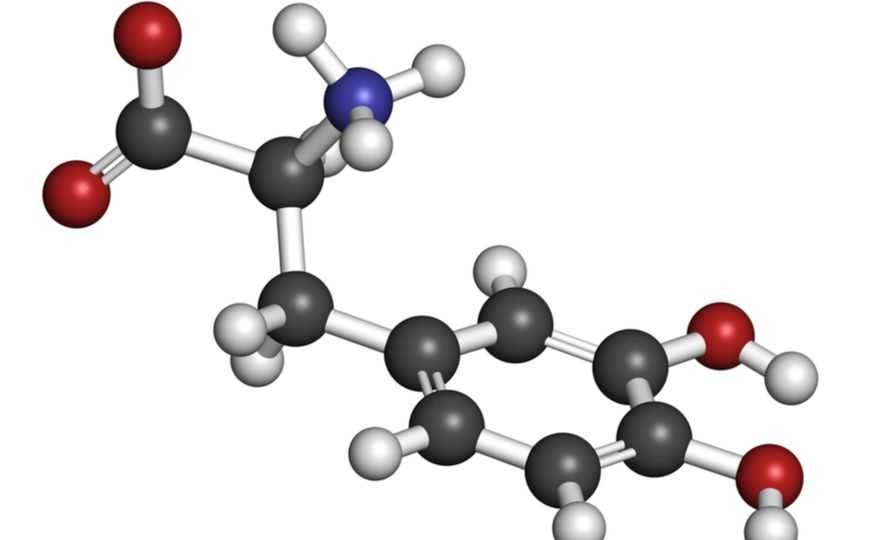
Структурная модель молекулы леводопы.
Credit: molekuul_be | Shutterstock.com
При лечении болезни Паркинсона первым делом используют леводопу (L-диоксифенилаланин). После пересечения ГЭБ она декарбоксилируется декарбоксилазой ароматических аминокислот (AADC) с образованием дофамина. Однако сам дофамин не может пересечь ГЭБ, и если декарбоксилирование происходит, например, в кишечнике, то получившийся дофамин бесполезен. Поэтому используют ингибиторы AADC, такие как карбидопа. Но даже несмотря на это, до 56% леводопы не попадает в мозг. Было известно, что важную роль в метаболизме леводопы в кишечнике играет его микрофлора, причем, скорее всего, происходит декарбоксилирование леводопы с образованием дофамина, который дегидроксилируется с образованием м-тирамина. Однако детали этих процессов оставались неизвестны.
Группа ученых из Гарвардского и Калифорнийского университетов предположила, что декарбоксилирующий фермент бактерий имеет кофактор пиридоксальфосфат (что типично для декарбоксилирующих ферментов). Поиск гомологов недавно найденного бактериального фермента TyrDC (декарбоксилирующего тирозин) выявил похожие белки у разных видов рода Enterococcus. Ученые выбрали несколько штаммов и проверили их на наличие декарбоксилирующей активности. Полностью декарбоксилировали леводопу только штаммы E.Faecalis. Но они не метаболизировали образовавшийся дофамин.
Штаммы, дегидроксилирующие дофамин, выделили в накопительной культуре. Ими оказались штаммы кишечной актинобактерии Eggerthella lenta. В ответ на добавление дофамина в этих штаммах повышался уровень экспрессии генов, предположительно кодирующих содержащий молибдоптерин фермент. Ученые заключили, что искомым ферментом является дофамин дегидроксилаза (Dadh). Действительно, лизат бактерий дегидроксилировал дофамин, причем данную активность имел именно Dadh (как подтвердила масс-спектрометрия).
Дальнейший анализ Dadh у штаммов E.lenta показал, что декарбоксилирует дофамин только фермент с единичной аминокислотной заменой: без этой замены бактерии не проявляют подобной активности, хотя экспрессия гена dadh все так же повышается в ответ на дофамин.
Как уже говорилось, обычно леводопу принимают в комплексе с ингибитором AADC карбидопой. Однако против бактериальной декарбоксилазы TyrDC данный ингибитор оказался неэффективен. В качестве замены ученые решили попробовать альфа-флуорометил аминокислоты — известные ингибиторы пиридоксальфосфат-зависимых декарбоксилаз. Поскольку субстратом TyrDC является и тирозин, то в качестве конкурентного ингибитора был выбран альфа-флуорометилтирозин (AFMT). Действительно, было показано, что AFMT предотвращает декарбоксилирование леводопы in vitro.
Чтобы проверить ингибирование in vivo, AFMT вместе с леводопой и карбидопой вводили мышам без собственной микрофлоры, но с одним из штаммов E. faecalis. По сравнению с контролем AFMT значительно увеличил сывороточную концентрацию леводопы, что подтверждает эффективность ингибирования у млекопитающих.
Различия в выявленных активностях микрофлоры у пациентов, возможно, и приводят к расхождениям в реакциях на лечение леводопой, обуславливая разную эффективность и разные побочные эффекты. Полученные результаты позволяют лучше понять вклад микрофлоры в исход лечения и доказывают преимущества подходов, которые учитывают метаболизм как человека, так и его микрофлоры.
Источник
Maini Rekdal V, Bess EN, Bisanz JE, et al // Discovery and inhibition of an interspecies gut bacterial pathway for Levodopa metabolism. // Science, 2019;364(6445). DOI: 10.1126/science.aau6323


 Меню
Меню





 Все темы
Все темы




 0
0