В Швеции разработали мультивалентные антитела против бета-амилоидов
Мультивалентные моноклональные антитела, созданные на основе антитела mAb158, обладают повышенной авидностью к самым опасным растворимым формам бета-амилоида — малым олигомерам и протофибриллам. В экспериментах in vitro они восстанавливали метаболическую активность клеток нейробластомы, поврежденных бета-амилоидом, с 43% до 74%.
Credit: Fadi Rofo, Uppsala University | Пресс-релиз
Группа ученых из Швеции получила шестивалентное моноклональное антитело против бета-амилоида, которое с высокой авидностью связывают растворимые амилоидные агрегаты.
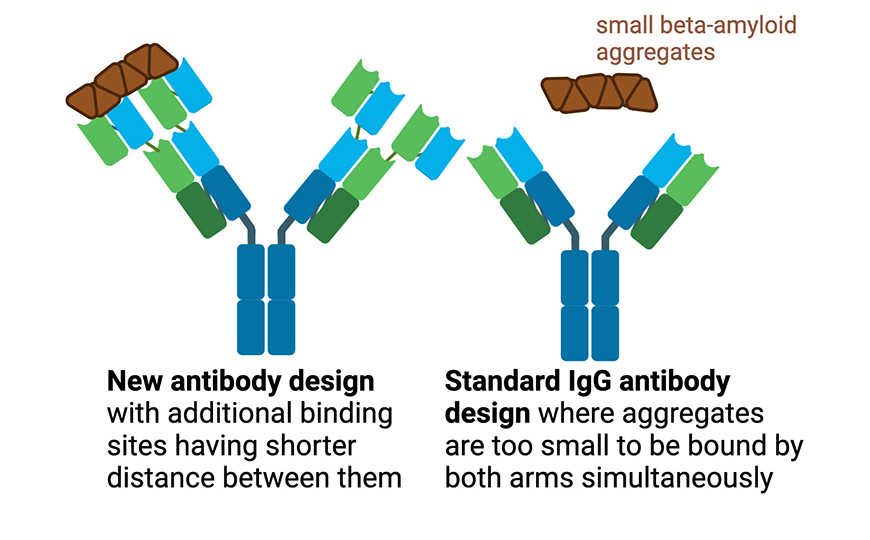
В настоящее время ведутся споры о том, какие формы бета-амилоида наносят больший ущерб организму. Однако в целом считается, что растворимые агрегаты токсичны для клеток: малые олигомеры бета-амилоида проникают в нейроны, а более крупные протофибриллы оказывают непрямой токсический эффект, усиливая нейровоспаление. Растворимые агрегаты бета-амилоида — привлекательная мишень для иммунотерапии болезни Альцгеймера. При этом мономеры бета-амилоида, по некоторым данным, имеют нейропротективные свойства. Целью авторов новой работы было увеличение авидности взаимодействия антитела с агрегатами и сохранение низкого уровня связывания его с мономерами. Антитела класса IgG плохо связывают небольшие молекулы, так как расстояние между паратопами (антиген-связывающими сайтами) слишком велико. Эту проблему можно решить увеличением количества паратопов.
За основу нового антитела ученые взяли мышиное моноклональное антитело mAb158 против протофибрилл бета-амилоида, гуманизированная версия которого тестируется в клинических испытаниях. Они добавили к вариабельным доменам исходного антитела дополнительные связывающие домены, получив таким образом четырех- и шестивалентные антитела. Схема антител представлена на иллюстрации. Антитела экспрессировали в клетках Expi293.
По результатам ИФА, лучше всего с олигомерами и протофибриллами бета-амилоидов связывалось шестивалентное антитело (его назвали Hexa-RmAb158). При этом его авидность по отношению к нерастворимым фибриллам и к мономерам была значительно ниже. Данные, полученные с помощью методов LigandTracer и поверхностного плазменного резонанса подтвердили высокую авидность антитела к протофибриллам — она была в 40 раз выше, чем у исходного антитела. Такой результат достигался за счет значительно сниженной диссоциации. Наконец, ученые проверили эффективность антитела на клеточной линии нейробластомы Neuro2a. Для оценки метаболической активности клеток использовали колориметрический МТТ-тест. При инкубации клеток с агрегатами бета-амилоидов МТТ-сигнал падал на 53%. Обработка Hexa-RmAb158 восстанавливала сигнал до 74%.
По мнению авторов, в будущем мультивалентные антитела можно будет использовать как для дигностических, так и для терапевтических процедур при болезни Альцгеймера. Они отмечают, что переформатирование для улучшения профилей связывания возможно и для антител, которые активно используются в борьбе с другими заболеваниями.
Источник
Rofo, F., et al. Novel multivalent design of a monoclonal antibody improves binding strength to soluble aggregates of amyloid beta. // Translational Neurodegeneration 10, 38 (2021), published online 28 September 2021. DOI: 10.1186/s40035-021-00258-x


 Меню
Меню





 Все темы
Все темы




 0
0








