Выключение белка MBD2 защищает модельных мышей от фиброза легких
Причины фиброза легких — опасного необратимого состояния, нарушающего дыхательную функцию, — до конца не изучены. Ученые обнаружили, что белок MBD2 опосредует образование макрофагов фенотипа M2. Такие макрофаги выделяют фактор TGF-β1, способствующий развитию фиброза легких. Нокаут mbd2 или деактивация мРНК защищает модельных мышей от повреждения легких при искусственно индуцированном фиброзе.
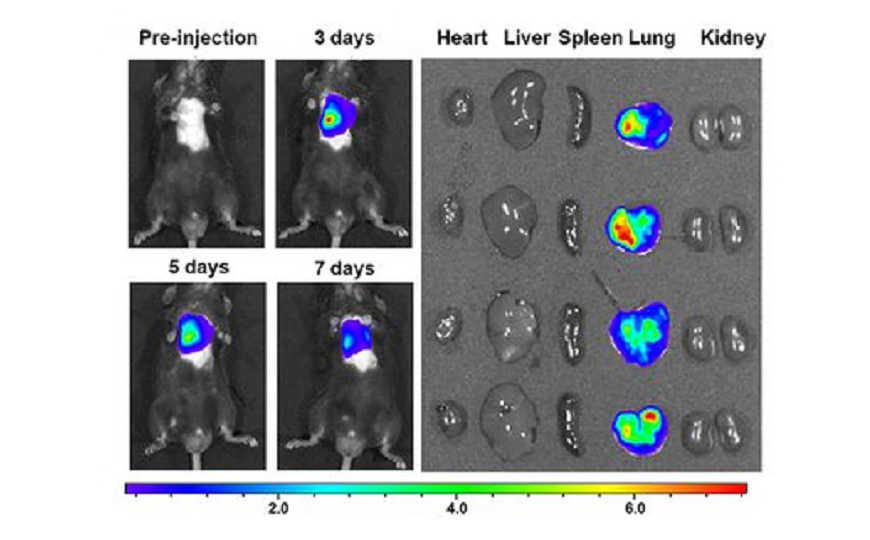
Credit: Yi Wang, et al., 2020; DOI: 10.1126/sciadv.abb6075 | CC BY-NC 4.0
Фиброз легких (pulmonary fibrosis, PF) — это хроническое прогрессирующее и необратимое заболевание. Фиброз может возникать как последствия других заболеваний либо без каких-либо идентифицируемых причин (идиопатический фиброз). Группа ученых из Китая показала, что развитие фиброза связано с экспрессией белка MBD2 в макрофагах, и этот белок может служить мишенью для лечения заболевания.
Макрофаги способны к дифференциации по двум программам — M1 и M2. M2-макрофаги производят TGF-β1 — фактор, индуцирующий развитие фиброза через дифференциацию фибробластов в миофибробласты. Ранее было показано, что с развитием PF также связано метилирование ДНК. Информация с метилированной ДНК считывается метил-ДНК-связывающими белками (MBD). Наибольшую активность из них проявляет MBD2, для которого уже известны ассоциации с аутоиммунными и нейродегенеративными заболеваниями.
В первую очередь ученые протестировали ткани пациентов с PF на уровень экспрессии MBD2. Анализ экспрессии в комбинации с иммунохимическим окрашиванием показали, что при любом виде фиброза наблюдается повышенная экспрессия MBD2 в M2-макрофагах. Анализ тканей, полученных от модельных мышей с блеомицин-индуцированным фиброзом, показал схожие результаты: на 21 день после индукции экспрессия MBD2 в легких повысилась в 8 раз. Это позволяет говорить о том, что PF характеризуется повышенной экспрессией MBD2 в M2-макрофагах.
Для уточнения роли MBD2 в развитии PF ученые вывели линию мышей, нокаутных по mbd2 (mbd2-CKO), и индуцировали у них фиброз. На 21 день после индукции у нокаутных мышей поражения легких были выражены в значительно меньшей степени по сравнению с контрольной линией.
Далее авторы измерили уровень экспрессии TGF-β1. У нокаутной линии был значительно снижен уровень экспрессии как белка, так и соответствующей мРНК. Дальнейший анализ сигнального пути TGF-β1 показал сильно меньшие концентрации активированных сигнальных молекул, принадлежащих к данному пути. При этом концентрации неактивированных молекул оставались неизменными. Также не наблюдалось изменения в концентрации мРНК основных рецепторов TGF-β1. Таким образом, отсутствие mbd2 подавляет способность макрофагов секретировать TGF-β1 и, как следствие, нарушает работу дальнейшего сигнального пути.
Анализ с помощью проточной цитометрии показал, что у нокаутных мышей концентрация M2-макрофагов снижена в 2,6 раза по сравнению с контролем. Чтобы глубже исследовать это явление, ученые отобрали неактивированные макрофаги из костного мозга разных линий мышей и искусственно стимулировали их активацию по пути M2. Макрофаги, полученные от нокаутных мышей, показывали значительно меньшие уровни маркеров M2-фенотипа. Эти данные подтверждают, что нокаут mdb2 подавляет активацию макрофагов по программе M2.
Чтобы проверить терапевтический потенциал воздействия на mdb2, ученые вводили мышам дикого типа липосомы, несущие малые интерферирующие РНК к mdb2 на 14 и 18 день после индукции фиброза. Липосомы облегчали симптомы и снижали концентрацию маркеров фиброза, не оказывая при этом токсического эффекта.
Авторы считают, что подобный метод терапии в перспективе может использоваться для лечения фиброза легких у человека.
Источник
Yi Wang, et al. // MBD2 serves as a viable target against pulmonary fibrosis by inhibiting macrophage M2 program. // Science Advances, eabb6075, published online 04 Dec 2020; DOI: 10.1126/sciadv.abb6075


 Меню
Меню





 Все темы
Все темы




 0
0







