Ядра из клеток мамонта проявили признаки активности в ооцитах мыши
Японские исследователи перенесли ядра из тканей сибирского мамонтенка Юки в мышиные яйцеклетки и наблюдали признаки биологической активности: сборку гистоновых комплексов, веретена деления и, вероятно, образование пронуклеусов. Оценка степени повреждения ДНК мамонта в клетках мыши дала обнадеживающие результаты.
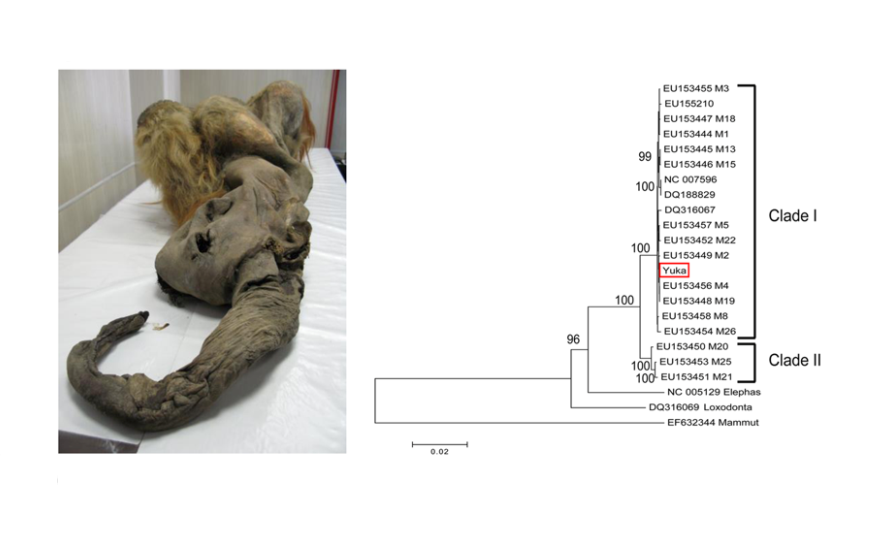
Отлично сохранившаяся мумия молодой самки мамонта была найдена в 2010 году членами общины Юкагир на южном побережье моря Лаптевых. Мамонтенка назвали Юкой, ее возраст по состоянию зубов оценили в 6—9 лет, радиоуглеродное датирование в рамках нового исследования показало, что животное умерло около 28 тыс. лет назад. (Более ранние датировки давали больший возраст — более 30 тыс. лет.) Группа японских исследователей в очередной раз попыталась перенести клеточные ядра, выделенные из тканей мамонта в клетку современного млекопитающего. Соавторами работы стали сотрудники Отдела изучения мамонтовой фауны Академии наук Республики Саха (Якутия).
Исследователи подтвердили подлинность образцов ткани с помощью полногеномного секвенирования, затем провели протеомный анализ. Данные о белках образца, полученные с помощью жидкостной хроматографии и тандемной масс-спектрометрии (LC-MS/MS), проверили по базе данных белков млекопитающих UniProt, включающей белки современных слонов, мамонта и американского мастодонта. В итоге 41,8% белков были идентифицированы как белки млекопитающих из отряда хоботных. Сравнительный анализ геномных последовательностей и протеомных данных также подтвердил, что белки действительно принадлежат мамонтенку, а не привнесены из окружающей среды.
Что интересно, в числе белков был обнаружен гистон H4. Поиск по базе данных всех видов млекопитающих выявил и другие ядерные белки — гистоны, шапероны гистонов, белки-участники процессинга или транспорта мРНК, а также белки ядерной мембраны. Авторы даже идентифицировали две хорошо известные регуляторные эпигенетические модификации гистонов.
Из 273,5 г ткани мамонта в общей сложности удалось получить 88 ядроподобных структур. Методы иммуноокрашивания единичных клеток мышечной ткани мумии, разработанные авторами, подтвердили, что в них содержатся ламин В2 и гистон Н3, ранее идентифицированные масс-спектрометрией. Это позволяло надеяться, что ядра не полностью разрушены и, если их перенести в живые клетки, проявят биологическую активность.
Ядра из тканей Юки и, для контроля, из замороженных тканей слонихи вводили в мышиные ооциты в метафазе II мейоза, а затем непосредственно в живых клетках демонстрировали восстановление веретена деления и других структур. (Для этого в ооциты вводили мРНК белков с флуоресцентными метками, участвующих в сборке этих структур.) Метафазную пластинку мышиных хромосом не удаляли: эндогенные клеточные структуры было нетрудно отличить по морфологическим характеристикам.
После переноса ядер исследователи наблюдали агрегацию гистонов, подтверждавшую возможность образования нуклеосом, в 96% ооцитов, содержащих ядра слона, и в 88% — мамонта. Кроме того, в 21% случаев мышиные ооциты начали формировать веретено деления рядом с ядерными структурами мамонта. Авторы отметили возникновение структур, напоминающих пронуклеусы, из хроматина слона или мамонта. Более того, часть хромосом мамонта с белками веретена, по-видимому, включилась в пронуклеусы мыши. Все реконструированные ооциты остановились в развитии, не пройдя первого деления, — очевидно, им не удалось пройти контроль на повреждения ДНК, отделяющий фазу покоя от метафазы.
Авторы работы также выяснили, насколько поврежден генома мамонта. Экстрагированная геномная ДНК в основном содержала фрагменты размером в несколько сот пар нуклеотидов (что соответствовало возможному присутствию в образце нуклеосом — структур, состоящих из октамера гистона и фрагмента ДНК не менее 146 п.н. ДНК в одной единице). Чтобы оценить целостность ДНК мамонта в ооцитах мыши, авторы использовали сигнал от фосфорилированного варианта гистона H2A.X (γH2A.X) — маркера двухцепочечных разрывов ДНК. Для сравнения взяли замороженную и свежую сперму мыши: замороженные сперматозоиды демонстрировали более сильные сигналы γH2A.X, чем свежие, а сигнал гистона H2B оставался на том же уровне, таким образом, степень повреждения можно было рассчитать как отношение сигналов γH2A.X/H2B. Если этот «индекс повреждения» для свежей спермы принять за 1, то у ядер, не поддерживающих эмбриональное развитие, он будет около 2. Что касается ядер мамонта Юки в ооцитах, «индекс повреждения» в отдельных случаях снижался почти до уровня свежих сперматозоидов. Как отмечают авторы, это говорит о том, что ядро мамонта способно стимулировать репарационную машину клетки.
У авторов это не первая попытка трансфера ядра мамонта в живую клетку: первая была предпринята десять лет назад и дала скромные результаты (клетки не погибли). Они отмечают, что в этот раз все получилось благодаря их новым методам скрининга ядроподобных структур в останках животного, переноса ядра и менее инвазивной визуализации.
Возможно, этот подход — использование клеточных механизмов ооцита — позволит задействовать и другие ядерные функции, например репликацию и транскрипцию ДНК и получить эмбриональные клетки с менее поврежденным ядерным материалом. Вывод, который делают сами авторы: клонировать мамонта с помощью современных технологий переноса ядра невозможно, но это перспективный метод для изучения активности ядерного аппарата вымерших видов животных.


 Меню
Меню





 Все темы
Все темы




 0
0