Антиоксидантный гидрогель сохраняет функцию изъятых для трансплантации островков Лангерганса
Исследователи из Северо-Западного университета и коллабораторы разработали новый антиоксидантный биоматериал, который полимеризуется при температуре тела и защищает изъятые при панкреатэктомии бета-клетки от стресса и разрушения под действием иммунитета. Подсаженные на сальник (или аналогичное место) островки помогали поддерживать эугликемию у модельных животных в течение всего периода исследования.
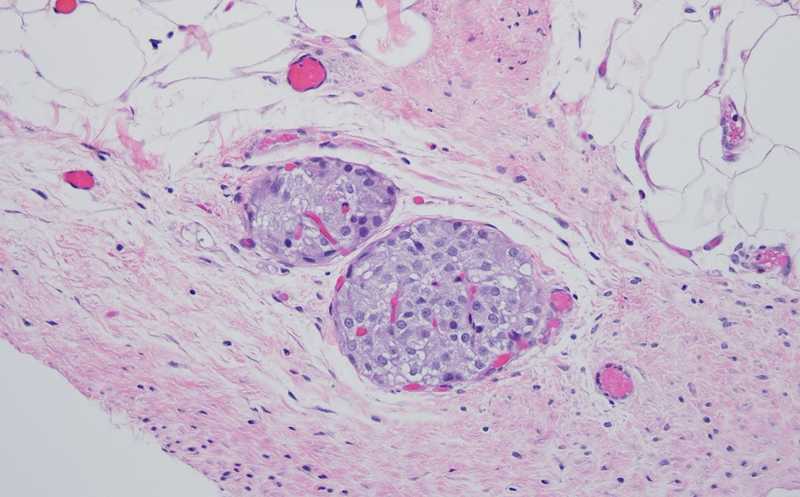
Для хронического панкреатита (ХП) характерно прогрессирующее воспаление ацинарной ткани поджелудочной железы. Пациенты с ХП страдают от болей, которые приводят к частым госпитализациям и инвалидности. По мере прогрессирования воспаления количество апоптотических ацинарных клеток возрастает, а масса бета-клеток, производящих инсулин, уменьшается. Универсального лечения заболевания не существует. Хирургическое вмешательство назначают, когда фармакологические методы уже не помогают. Такие пациенты подвергаются тотальной панкреатэктомии (TP) с последующей аутотрансплантацией островков бета-клеток в печень (IAT), процедура известна как TP-IAT. Хотя техника пересадки островков значительно улучшилась за последние годы, долгосрочные результаты остаются неудовлетворительными. Тромбоз печени, мгновенная воспалительная реакция, вызванная контактом крови с изолированными островками, и окислительный стресс приводят к значительному повреждению пересаженных островков. В итоге около 50–80% островков разрушаются, а у трети пациентов, перенесших TP-IAT, развивается диабет после операции. Через три года после операции 70% пациентов нуждаются в инъекциях инсулина. Ученые и врачи давно ищут новые способы повышения выживаемости островков при трансплантации.
В недавно опубликованном исследовании ученые из Северо-Западного университета и коллабораторы пересадили островки из поджелудочной железы в сальник вместо печени. Чтобы создать более здоровую микросреду для островков, исследователи прикрепили их к сальнику с помощью антиоксидантного и противовоспалительного биоматериала, который быстро превращается из жидкости в гель при температуре тела.
Ученые использовали макромолекулу PPCN, содержащую цитрат. Для проверки антиоксидантных свойств PPCN они проанализировали, может ли она подавлять активацию NF-κB в клеточной линии RAW-Blue. PPCN снижала активацию на 84% по сравнению с клетками, подвергшимися воздействию липополисахарида. Ученые также оценили жизнеспособность и функциональность мышиных островков, обработанных PPCN. В экспериментах in vitro островки оставались жизнеспособными в течение 48 часов. Функциональность островков оценивали по секреции инсулина в ответ на стимуляцию глюкозой. В течение 24–48 часов снижение секреции составило 25% для культуры в суспензии и 7,3% для PPCN. Аналогичные результаты наблюдались для человеческих островков.
В исследованиях на мышах и обезьянах гель предотвращал окислительный стресс и воспалительные реакции, значительно улучшая выживаемость и сохраняя функцию пересаженных островков. Это первый случай использования синтетического антиоксидантного геля для этой цели. По словам Гильермо А. Амеера, профессора кафедры биомедицинской инженерии Северо-Западного университета и руководителя исследования: «Мы разработали передовой синтетический материал, который обеспечивает поддерживающую микросреду для функционирования островков. При испытаниях на животных мы добились успеха. Он максимизировал функцию островков и восстановил нормальный уровень сахара в крови. Мы также сообщаем о снижении количества единиц инсулина, необходимых животным».
Далее ученые проверили, смогут ли прижиться островки с гидрогелем в организме. Для оценки возможности использования PPCN для доставки островков в экстрапеченочные участки был выбран брюшной жировой слой мышей, чтобы имитировать трансплантацию островков в сальник у людей. После нанесения на жировую ткань полное гелеобразование PPCN происходило в течение нескольких секунд, что обеспечивало фиксацию островков на жировой ткани. Благодаря свойствам PPCN, не требовалось швов или тканевых клеев. Вся процедура занимала не более пяти минут. Нормальный уровень глюкозы в крови достигался уже на следующий день после операции и сохранялся до 104-го дня. Удаление трансплантированных островков у мышей вызвало гипергликемию, доказывая, что именно островки в жировой ткани являлись местами выработки инсулина.
Из-за сложной морфологии поджелудочной железы у пациентов с панкреатитом изоляция островков является технически сложной задачей, и их выход значительно ниже по сравнению со здоровым донором. Для оценки способности PPCN сохранять функцию островков и поддерживать нормогликемию при панкреатите в последующем исследовании использовали меньшее количество островков. При использовании 4100 изоэквивалентов островков (IEQ) на килограмм массы тела восстановление нормогликемии заняло больше времени по сравнению с трансплантацией 8200 IEQ. Животные, которым трансплантировали островки в печень, почечную капсулу, брюшной жировой слой с использованием гидрогеля из биологического каркаса и PPCN, достигли устойчивой эугликемии в среднем за 5, 4, 39 и 16 дней соответственно.
Гистологическое и иммуннофлуоресцентное окрашивание провели на извлеченных трансплантатах островков (жировая подушка и почечная капсула). Использование антител против инсулина и α-SMA подтвердило выработку инсулина, наличие целостных структур островков и неоваскуляризацию в трансплантированных островках. Как биологический каркас, так и PPCN были полностью абсорбированы, оставив островки, окруженные жировой тканью. Благоприятное приживление островков благодаря PPCN подтверждается большими размерами островков и большим количеством сосудов по сравнению с островками, трансплантированными с использованием биологического каркаса. Также островки, трансплантированные при помощи PPCN, испытывали меньший окислительный стресс.
Это первое исследование, продемонстрировавшее возможность пересадки островков в жировую ткань и сохранения их функциональности при использовании антиоксидантного геля PPCN. «С этим новым подходом мы надеемся, что пациентам больше не придется выбирать между болью при хроническом панкреатите и осложнениями диабета», — добавила Жаклин Берк, научный сотрудник кафедры биомедицинской инженерии Северо-Западного университета и первый автор статьи. В дальнейшем исследователи планируют тестировать гидрогель на животных моделях в течение более длительного времени.
Источники:
Jacqueline A. Burke, et al., Phase-changing citrate macromolecule combats oxidative pancreatic islet damage, enables islet engraftment and function in the omentum. // Science Advances 10,eadk3081(2024). DOI: 10.1126/sciadv.adk3081
Цитаты по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0







