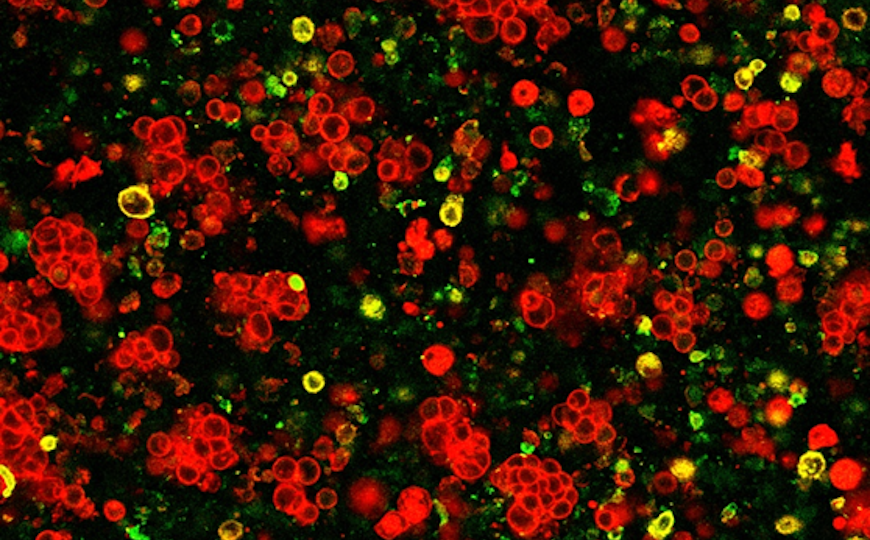
Антитела на магнитах: новый метод CRISPR-скрининга
Функциональный геномный скрининг позволяет выделить генетические регуляторы интересующего фенотипа. Однако идентификация полученных модификаций требует сортировки большого числа клеток, что значительно увеличивает количество времени и средств, затрачиваемых на исследования. Учёные из университета Торонто предложили новый способ скрининга, основанный на применении системы CRISPR-Cas9 и иммуномагнитной сортировки клеток.
Nathan Devery | Shutterstock.com
Поиск генов-мишеней, перспективных для разработки лекарств, — процесс длительный и трудоёмкий. Один из методов включает в себя внесение модификаций в геном популяции клеток при помощи системы CRISPR-Cas9. Модификации вносятся сразу во множество генов — в разных клетках мишенями будут разные последовательности, в зависимости от того, какие гид-РНК трансдуцируют конкретную клетку. Затем нужно выявить клетки интересующего фенотипа. Например, можно таким образом искать гены, регулирующие экспрессию какого-нибудь мембранного белка: те клетки в культуре, в которых эти гены-регуляторы были нокаутированы системой CRISPR-Cas9, будут иметь больше или меньше этого белка на поверхности.
Проблема в том, что клеток с необходимой модификацией при такой схеме будет немного, более того, степень выраженности изменений фенотипа под действием разных генов-регуляторов может варьировать, и клетки нужно отсортировать. «Золотой стандарт» такой сортировки — проточная цитометрия — занимает довольно много времени, особенно если количество образцов велико. Учёные из университета Торонто предложили новый метод сортировки, основанный на том, что интересующие клетки метят антителами, связанными с магнитными частицами, — микрофлюидную клеточную сортировку (microfluidic cell sorting, MICS). Меченые клетки движутся вдоль ферромагнитных направляющих с током жидкости и сортируются по количеству накопленных частиц.
MICS позволяет за один час обработать образец, анализ которого при помощи проточной цитометрии занял бы 20–30 часов. Клетки сортируются на несколько групп, в зависимости от доли накопленных магнитных частиц, точность сортировки регулируется скоростью тока жидкости. По словам авторов, данный метод может занять нишу между магнитно-активированной сортировкой клеток (MACS) и проточной цитометрией.
Эффективность MICS авторы продемонстрировали на примере CRISPR-Cas9 скрининга на потерю функции гликопротеина CD47 в раковых клетках. Этот гликопротеин позволяет им «замаскироваться» под клетки хозяина и избежать атаки со стороны иммунной системы. Терапия, направленная на прямое блокирование функции CD47, несёт ряд серьёзных побочных эффектов, поэтому целью исследования было выявить сторонние гены, регулирующие уровень этого белка. Авторы провели скрининг на примере клеточной линии HAP1 (хронический лейкоз), а затем рассортировали клетки при помощи MICS и проточной цитометрии для сравнения результатов, используя антитела к CD47. Оба метода с высокой достоверностью выявили несколько генов: QPCTL, кодирующий глутаминил-циклазу, модифицирующую N-концевой домен CD47, а также гены белков-транспортеров пироглутамата — SLC16A1 и SLC7A11.
«Если вы сможете модулировать уровни CD47, воздействуя на QPCTL, это может стать интересным способом обмануть иммунную систему для лечения рака», — комментирует Джейсон Моффат, один из авторов работы и профессор в центре клеточных и биомолекулярных исследований Доннели (Donnelly Centre for Cellular and Biomolecular Research).
Устройство для анализа представляет собой чип размером с половину кредитной карты и, по словам авторов, в данный момент ведётся разработка протоколов и дружественного интерфейса, чтобы сделать технологию доступной для широкого круга специалистов. «Мы можем обработать порядка миллиарда клеток, одновременно перемещающихся по магнитным направляющим, за один час. Это огромный прорыв для технологии CRISPR-скрининга», — говорит Шана Келли, ведущий автор работы.
Источник
Barbara Mair et al. // High-throughput genome-wide phenotypic screening via immunomagnetic cell sorting // Nature Biomedical Engineering, 2019; DOI: 10.1038/s41551-019-0454-8
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы



 0
0