Астроциты полосатого тела модулируют поведение при когнитивных и психических расстройствах
Ученые из США исследовали функции Crym+ астроцитов, которые сосредоточены в полосатом теле и экспрессируют μ-кристаллин — белок с неизвестными функциями. Мыши с нокаутом по Crym были склонны к навязчивым повторяющимся действиям, характерным для ряда нейропсихиатрических расстройств. У них также был нарушен баланс между возбуждающими и тормозными сигналами в мозге. Сами Crym+ астроциты оказались ответственными за гомеостаз ГАМК в полосатом теле.
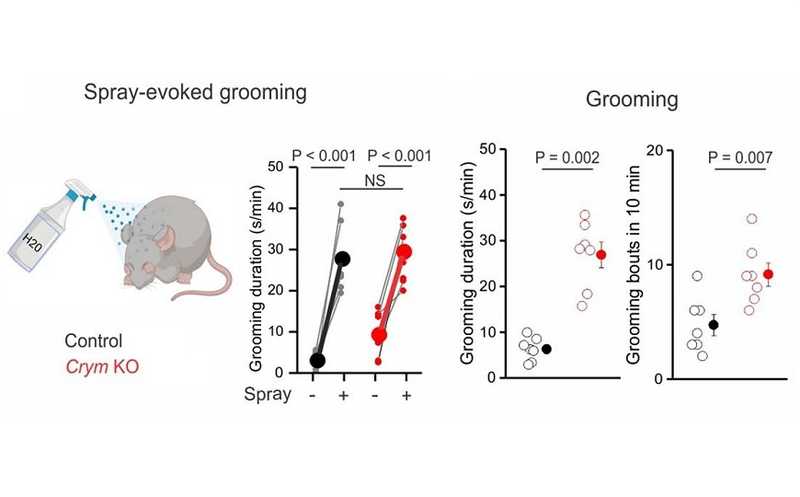
Мыши с нокаутом Crym тратили больше времени на уход за шерсткой, чем контрольные, но не тогда, когда мышей опрыскивали водой.
Credit:
Nature (2024). DOI: 10.1038/s41586-024-07138-0 | CC BY 4.0 DEED
Астроциты — самый многочисленный тип нейроглии. Они поддерживают нейроны, снабжают их питательными веществами, а также могут регулировать их активность. Недавние исследования показали, что астроциты — гетерогенная популяция клеток: для разных анатомических регионов мозга характерны специфические типы астроцитов. Ученые из Калифорнийского университета в Лос-Анджелесе исследовали Crym+ астроциты, которые представлены в полосатом теле переднего мозга. Crym кодирует μ-кристаллин — цитозольный белок, функции которого не до конца понятны, однако он может контролировать влияние гормона щитовидной железы Т3 на экспрессию генов и выступать в роли кетиминредуктазы. У людей CRYM ассоциирован с различными нейропсихиатрическими расстройствами, в том числе с болезнью Гентингтона, с боковым амиотрофическим синдромом и с шизофренией.
Для изучения Crym+ астроцитов на мышах ученые сделали нокаут этого гена с помощью CRISPR/Cas9. Далее они сравнивали поведение мышей, оценивая их моторные функции, проявления тревожности и персеверации — навязчивого повторения каких-либо действий. Также оценивали влияние Crym на синапсы и обмен нейромедиаторами между нейронами.
Контрольные и Crym- мыши практически не различались внешне и по моторным функциям, однако по-разному проявляли себя в некоторых поведенческих тестах. Например, для оценки тревожности и поведения, ассоциированного с обсессивно-компульсивным расстройством (ОКР) часто используется тест на закапывание шариков. Мышей помещают в незнакомое помещение, где лежат шарики, при этом мчитается, что чем больше мыши их закопают, тем более для них характерна тревожность и персеверация. Crym- мыши по сравнению с контрольными быстрее приступали к закапыванию шариков и проводили больше времени за этим занятием. Кроме того, они дольше занимались чисткой шерстки, хотя если мышей обеих групп намеренно опрыскивали водой, то разницы в этом поведении не было (а значит, продолжительность груминга не была связана с меньшей ловкостью или большей потребностью в чистке).
Группы различались также и в тесте по распознаванию новых объектов. Мышей сажали в клетку с двумя объектами и давали им «познакомиться» с ними, а через сутки один из объектов заменяли на другой. Crym- мыши больше времени проводили со знакомым объектом, чем контрольные, что может указывать на склонность к персеверации. Такое поведение характерно для синдрома Туретта, аутизма, ОКР, болезни Гентингтона.
Разницы между Crym- и Crym+ астроцитами практически не было ни по морфологическим признакам, ни по экспрессии маркеров астроцитов. Исследователи также не зарегистрировали потери нейронов или астроцитов в мозге Crym- мышей, но решили оценить влияние Crym на нейроны и синапсы. Полосатое тело — часть кортикостриатально-таламокортикальной петли базальных ганглий, в нее приходят сигналы от коры. Чтобы оценить влияние Crym на эту петлю, ученые оценили экспрессию cFOS — маркера нейрональной активности. У Crym- мышей было больше cFOS+ нейронов в орбитофронтальной коре, центральном полосатом теле и заднем таламусе. При этом больше всего проекций в полосатое тело шло именно от орбитофронтальной коры. Ученые предположили, что Crym может влиять на коммуникацию между этими регионами мозга. Это согласуется с литературными данными о том, что при ОКР чрезмерно активирована проекция от орбитофронтальной коры к полосатому телу.
Исследуя постсинаптические токи, исследователи сделали вывод, что у Crym- мышей нарушен баланс между возбуждением и торможением (E/I) синапсов в сторону чрезмерного возбуждения. Это характерно для многих психиатрических заболеваний. С помощью газовой хроматографии и масс-спектрометрии ученые оценили также соотношение между глутаматом и ГАМК в образцах, полученных из мозга мышей, так как эти нейромедиаторы ответственны за возбуждение и торможение соответственно. У Crym- мышей соотношение между глутаматом и ГАМК было повышено, что также указывает на чрезмерное возбуждение.
У Crym- мышей в целом содержание ГАМК оказалось пониженным во внеклеточном пространстве полосатого тела. Причиной оказался не GAT3 (транспортер ГАМК во внеклеточное пространство), так как его экспрессия не менялась в астроцитах Crym- мышей. При этом в них был повышен уровень моноаминоксидазы B — фермента астроцитов, который ответственен за синтез ГАМК. Это объяснило, почему у Crym- мышей было меньше тормозных сигналов между синапсами.
Ученые также показали, что E/I дисбаланс в Crym- мышах можно скорректировать фармакологически. Сначала с помощью аденоассоциированного вируса они доставляли в нейроны орбитофронтальной коры DREADD rg-hM4Di — искусственный рецептор, активируемый только конкретным препаратом. Затем мышам вводили агонист этого рецептора — дезхлороклозапин. Это восстанавливало E/I баланс в Crym- мышах. Когда то же проделывали, доставляя rg-hM4Di в полосатое тело, у Crym- мышей исчезали персеверации в тестах на закапывание шариков и на изучение нового объекта, они стали меньше времени проводить за умыванием.
Сравнивая Crym+ и Crym- астроциты, ученые показали, что они различались экспрессией GAT3 и количеством ГАМК, транспортированной во внеклеточное пространство. На основе этого они заключили, что основная функция Crym+ астроцитов — поддержание гомеостаза ГАМК, а нарушение этого процесса приводит к персеверациям.
Напоследок ученые попытались определить функции белка μ-кристаллина. По результатам секвенирования РНК они сделали вывод, что μ-кристаллин влияет скорее на клеточный сигналинг, а не на Т3-зависимую экспрессию генов. Они идентифицировали 21 белок, с которым взаимодействует μ-кристаллин. В основном эти белки располагались в цитозоле или вблизи плазматической мембраны и были ответственны за связывание с нуклеиновыми кислотами, трансдукцию внутриклеточных сигналов или за взаимодействие с цитоскелетом. При этом экспрессия около трети белков, взаимодействующих с μ-кристаллином, понижена при ОКР и болезни Гентингтона, что следует из секвенирования РНК посмертных тканей. В интерактоме этого белка были обнаружены продукты генов SYNGAP1, DLGAP2, DLGAP3, BCR, CLINT1, GSTM1 и MT-ND5, которые также ассоциированы с психиатрическими заболеваниями.
Таким образом, показана роль ненейрональных клеток в модулировании поведения при некоторых нейропсихиатрических расстройствах, что открывает новые перспективы для терапии.
Источник
Ollivier, M. et al. Crym-positive striatal astrocytes gate perseverative behaviour // Nature (2024). DOI: 10.1038/s41586-024-07138-0








 Меню
Меню





 Все темы
Все темы





 0
0