Праймированное редактирование позволило провести системный скрининг мутаций TP53
Мутации при раке бывают очень разнообразны — для самого часто мутирующего в опухолях человека гена TP53 известно более тысячи вариантов. Чтобы систематически охарактеризовать эти изменения, авторы работы в Nature Biotechnology модифицировали метод праймированного редактирования и создали систему скрининга на его основе. Их подход позволил оценить, как разные последовательности р53 влияют на рост и развитие опухолевых клеток; кроме того, ученые выявили новые патогенные варианты, которые не детектировались скринингом с помощью кДНК.
p53
Credit:
123rf.com
Опухолевые мутации отличаются широким разнообразием. Так, самый часто мутирующий ген — супрессор опухолевого роста TP53 — может подвергаться более чем тысяче вариантов «поломок». Именно на его примере авторы статьи в Nature Biotechnology продемонстрировали работу нового подхода к скринингу мутаций, который основан на праймированном редактировании (prime editing).
В систему для праймированного редактирования входят pegRNA (prime editing guide RNA), содержащая гидовый участок, нужный для поиска редактируемого фрагмента в геноме, и целевую последовательность, на которую этот фрагмент нужно заменить. Авторы работы учли некоторые недостатки, которые ограничивают применение таких систем для скрининга — ограниченное количество pegRNA, невозможность количественной оценки внесенных изменений и риск внесения нежелательных инсерций/делеций. Чтобы расширить возможности праймированного редактирования, ученые дополнили pegRNA «сенсорным» сайтом. Этот сайт, по задумке исследователей, должен быть специфичным для конкретного варианта и повторять естественную архитектуру целевого участка.
Для разработки библиотек pegRNA ученые создали и выложили в открытый доступ пакет на Python, который получил название PEGG (Prime Editing Guide Generator). Он позволяет конструировать pegRNA для тысяч генетических вариантов и одновременно генерировать для них сенсорный сайт.
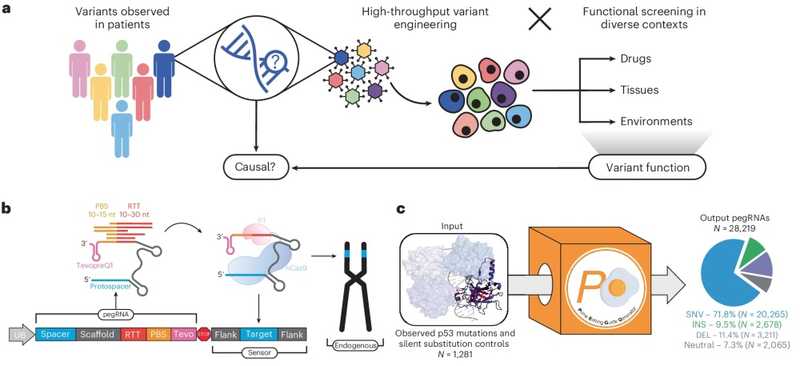 Новый подход к скринингу направлен на выявление мутантных вариантов, встречающихся у пациентов, и описание их функциональной роли. Праймированное редактирование позволяет вносить мутации в эндогенный TP53, а его модификация повышает точность нацеливания системы редактирования.
Новый подход к скринингу направлен на выявление мутантных вариантов, встречающихся у пациентов, и описание их функциональной роли. Праймированное редактирование позволяет вносить мутации в эндогенный TP53, а его модификация повышает точность нацеливания системы редактирования.Credit:
Nature Biotechnology, 2024. DOI: 10.1038/s41587-024-02172-9 | CC BY
С помощью разработанного пакета авторы сгенерировали библиотеку из более чем 28 000 pegRNA, нацеленных на 1000 вариантов TP53. Эту библиотеку они протестировали на клетках аденокарциномы легкого человека. Клетки трансдуцировали аденоассоциированными вирусными векторами, кодирующими pegRNA. На четвертый день часть клеток обрабатывали нутлином-3 — малой молекулой, которая ингибирует MDM2 и тем самым активирует путь p53. Таким способом можно отобрать мутации в TP53, способствующие обходу p53-зависимой остановки клеточного цикла. После культивирования клеток авторы секвенировали их геномную ДНК, чтобы оценить активность pegRNA и результаты редактирования целевого сайта.
Как и предполагали авторы, обработка нутлином-3 повысила соотношение сигнал/шум; также она способствовала отбору pegRNA с более высокой эффективностью редактирования. Для нескольких вероятно патогенных вариантов TP53, включая R196P и R267P, анализ выявил значимое обогащение в обеих группах (с обработкой нутлином-3 и без нее).
Следующим шагом работы стала функциональная валидация патогенных вариантов TP53. По результатам скрининга авторы отобрали 29 pegRNA, уровень которых в клетках значимо менялся или которые генерировали мутации в «горячих точках». Конструкты с pegRNA они пометили красным флуоресцентным белком (RFP), чтобы отслеживать, как меняется приспособленность клеток с мутацией по сравнению с родительскими клетками. После обработки смешанной популяции нутлином-3 RFP+ клеток становилось больше, то есть их способность к размножению возрастала из-за мутации.
Авторы показали также, что подход можно использовать для определения чувствительности клеток с конкретной мутацией к лекарственным препаратам. Они протестировали две малых молекулы — COTI-2 и PK7088 — на клетках, в которые с помощью pegRNA вносили замены R175H и Y220C, соответственно. В обоих случаях фракция RFP+ клеток истощалась, что указывает на чувствительность каждой из мутантных линий к своему тестируемому соединению.
Наконец, предложенный метод скрининга позволил исследователям выявить новые патогенные варианты в TP53. Ученые сравнили полученные данные с результатами скрининга кДНК и показали, что некоторые мутации, в частности, в олигомеризационном домене белка, проявляют себя по-разному в эндогенном (отредактированном) и экзогенном (внесенном с помощью кДНК) белке — их роль в патологии выявлялась только в эндогенном контексте.
Исследование точечных мутаций открывает большой потенциал для понимания индивидуальных особенностей развития тех или иных заболеваний. Предложенный метод скрининга, основанный на праймированном редактировании, делает возможным тщательное экспериментальное изучение генетических вариантов, ассоциированных с раком. Авторы работы рассчитывают, что их подход поможет подобрать эффективные методы лечения для онкологических больных или пациентов с генетически обусловленными заболеваниями.
Источник
Gould, S.I. et al. High-throughput evaluation of genetic variants with prime editing sensor libraries // Nature Biotechnology, 2024. DOI: 10.1038/s41587-024-02172-9


 Меню
Меню





 Все темы
Все темы




 0
0








