Белок Ang2 может улучшить состояние сердечно-сосудистой системы у пациентов с прогерией
Детская прогерия — редкое генетическое заболевание, которое проявляется в виде преждевременного старения у детей. Такие пациенты чаще всего погибают от сердечно-сосудистых заболеваний. Ученые из США показали, что при прогерии снижается экспрессия факторы ангиопоэтина 2 (Ang2), стимулирующего рост сосудов, и это нарушает коммуникацию между эндотелиальными клетками. Повышение уровня Ang2 восстанавливает функцию эндотелиальных клеток и формирование сосудистой сети, что делает его перспективным препаратом для улучшения состояния сердечно-сосудистой системы у пациентов с прогерией.
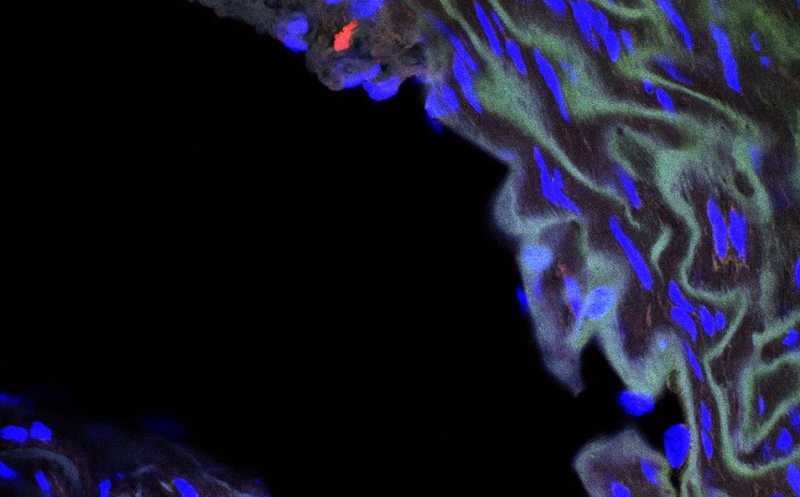
Аорта мыши дикого типа, ламин A/C покрашен зеленым, Ang2 — красным, ядро — синим.
Credit:
Image courtesy of Sahar Vakili/UMD | Пресс-релиз
Синдром Хатчинсона — Гилфорда, более известный как детская прогерия, — редкое генетическое заболевание, которое проявляется в виде преждевременного старения у детей. Оно возникает вследствие точечной мутации в гене LMNA, кодирующем ламин А, из-за которой образуется токсичная форма этого белка, называемая прогерином. Основная причина смерти таких пациентов — это атеросклероз, приводящий к инфарктам и инсультам. Значительный вклад развитие сердечно-сосудистых заболеваний, связанных с прогерией, вносит дисфункция эндотелиальных клеток (ЭК), которые выстилают стенки сосудов, в особенности — коммуникации между этими клетками. Важно, что такая дисфункция считается ранним событием в развитии сердечно-сосудистых патологий и потенциально обратима. Таким образом, поиск стратегий, которые могут предотвратить или обратить вспять дисфункцию эндотелиальных клеток, — актуальная и перспективная задача.
Исследователи из США изучили до сих пор не установленную роль проангиогенного фактора роста ангиопоэтина 2 (Ang2) и прогерина в межклеточных взаимодействиях ЭК и опубликовали результаты в журнале Aging Cell.
В прогероидных клетках, ранее полученных в лаборатории на основе индуцированных плюрипотентных стволовых клеток (ИСПК) человека, было обнаружено тринадцатикратное снижение уровня Ang2 на уровне транскриптов по сравнению с контрольными. Концентрация Ang2 в секретоме прогероидных клеток была шесть раз меньше, чем в контрольных, в то время как концентрации некоторых компонентов секреторного фенотипа, ассоциированного со старением, оказались повышены. Авторы обнаружили снижение уровня Ang2 на уровне транскриптов и на уровне белка в стенке аорты модельных мышей с прогерией. Таким образом, подавление экспрессии Ang2 является общим фенотипическим признаком для мышиной модели прогерии и прогероидных клеток, полученных из ИСПК человека.
Добавление Ang2 извне восстанавливало процесс формирования сосудов прогероидными эндотелиальными клетками. Это происходило дозозависимым образом за счет нормализации взаимодействий между ними. При этом ингибирование Ang2 нарушало коммуникацию между ЭК, что приводило к дефектам развития сосудистой сети. Добавление Ang2 к прогероидным ЭК нормализовало их миграцию, профиль экспрессии генов, а также биодоступность оксида азота (NO) за счет активации эндотелиальной синтазы оксида азота (eNOS). Снижение экспрессии этого фермента также характерно для прогероидных клеток.
Наконец, эндотелиальные клетки HUVEC, в которых эктопически экспрессировали прогерин, хуже формировали сосудистую трубку и имели сниженную экспрессию Ang2. После обработки HUVEC, экспрессирующих прогерин, различными дозами Ang2, восстанавливалась их способность к формированию сосудов. Кроме того, возвращение нормальной формы прогерина в модельных ЭК с помощью генетического редактирования полностью восстанавливало уровень мРНК Ang2 и значительно повышало концентрацию белка Ang2, при этом восстанавливая способность к формированию сосудистой сети. Так ученые подтвердили свое предположение о том, что прогерин приводит к нарушению ангиогенеза путем подавления уровней Ang2. Далее ученые установили, что Ang2 оказывает свое положительное влияние на ЭК через связывание рецептора Tie2, активируя Akt-опосредованный путь.
«Хотя Ang2 имеет рецепторы только на эндотелиальных клетках, он может оказывать более широкое благотворное влияние на другие типы тканей, помимо сердечно-сосудистой системы, такие как костная и жировая ткани, поскольку кровеносные сосуды необходимы нашему организму для транспортировки питательных веществ, кислорода и отходов», — сказала Кан Цао, профессор Университета Мэриленда и последний автор исследования.
Полученные данные позволили раскрыть молекулярные механизмы нарушения формирования сосудов у пациентов с прогерией и подтвердить потенциальную перспективность терапевтического применения Ang2 при сердечно-сосудистых заболеваниях, ассоциированных с прогерией.
Генная терапия гладкомышечных клеток предотвращает атеросклероз в мышиных моделях прогерии
Источники:
Vakili S., et al. Angiopoietin-2 reverses endothelial cell dysfunction in progeria vasculature. // Aging Cell, 00, e14375. (2024) DOI: 10.1111/acel.14375
Цитата про пресс-релизу.


 Меню
Меню





 Все темы
Все темы




 0
0







