Белок FMLN2 обеспечивает транспорт везикул с проонкогенным белком
Везикулярный транспорт играет важную роль в секреции проопухолевых молекул и, как следствие, в развитии и распространении рака. Такой транспорт возможен в первую очередь благодаря перестройкам цитоскелета. Немецкие ученые показали, что белок FMLN2 участвует в транспорте везикул, несущих проопухолевый белок ANGPTL4.
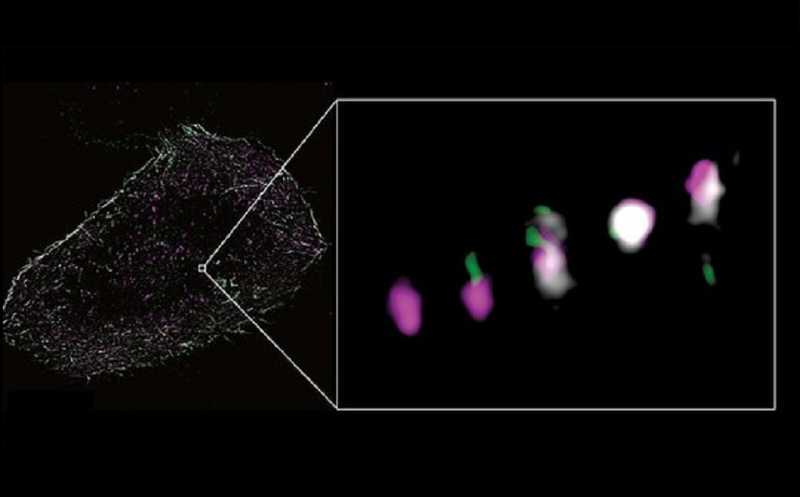
Прометастатический фактор ANGPTL4 окрашен пурпурным, белок FMNL2 — зеленым, а актин — белым. На врезке — одна везикула, содержащая ANGPTL4, в несколько последовательных моментов времени. FMNL2 (зеленый) индуцирует полимеризацию актиновых филаментов рядом с везикулой, продвигая ее вперед.
Credit:
Dennis Frank | Пресс-релиз Фрайбургского университета
Цитоскелет — один из важнейших клеточных компонентов; он отвечает за поддержание формы клетки, ее движение, а также за перемещение и секрецию молекул. Важную роль цитоскелет играет в метастазировании рака. Во-первых, мигрирующие раковые клетки претерпевают множественные изменения в структуре и организации цитоскелета, которые облегчают их перемещение и образование вторичных очагов опухолевого роста. Во-вторых, опухолевые клетки используют везикулы, несущие проонкогенные молекулы, для стимулирования прогрессии рака.
Для секреции везикул необходим их внутриклеточный транспорт по филаментам цитоскелета. Группа ученых из Фрайбургского университета (Германия) описала механизм участия белка FMLN2 из семейства форминов в транспорте и секреции везикул, несущих проонкогенный белок ANGPTL4, посредством полимеризации актина. Экспрессия этого белка индуцируется еще одним проопухолевым белком — TGFβ. Таким образом, в данном исследовании изучали роль FMLN2 в TGFβ-ANGPTL4 сигнальном пути на клетках в культуре.
В первую очередь авторы оценили роль FMLN2 в сигнальном пути TGFβ. Для этого на клетки подействовали TGFβ и оценили активацию (фосфорилирование) FMLN2, обнаружив прямую зависимость: TGFβ вызывал активацию FMLN2. Чтобы проанализировать, как это влияет на инвазивность клеток, авторы использовали метод 3D Matrigel invasion assays — выращивали клетки в 3D культуре и наблюдали за их подвижностью. Клетки с нокаутом FMNL2 не реагировали на стимуляцию TGFβ, тогда как клетки со сверхэкспрессией FMNL2 демонстрировали повышенную инвазивность.
Из литературных данных было известно, что TGFβ может способствовать распространению опухолевых клеток через секретируемый гликопротеин ANGPTL4. Авторы обнаружили снижение секреции ANGPTL4 при нокауте FMLN2 и сделали вывод о наличии связи между этими тремя белками.
Следующим шагом стала визуализация перемещения везикул с ANGPTL4 в клетках после стимуляции TGFβ. Для этого авторы использовали флуоресцентную метку mCherry, сшитую с ANGPTL4. При воздействии TGFβ возрастало количество везикул, несущих ANGPTL4, наблюдалось их активное движение и транспорт как внутри, так и снаружи клетки, тогда как при отсутствии стимуляции везикулы с ANGPTL4 находились главным образом в ядре. Похожий эффект вызывала активация FMLN2.
Таким образом, было установлено, что TGFβ и FMLN2 действительно стимулируют синтез, распределение и секрецию везикул с ANGPTL4. Эти результаты были также подтверждены прямым наблюдением транспорта ANGPTL4 в живых клетках, которые экспрессировали конструкт FMNL2-GFP, с помощью микроскопии структурированного освещения (SIM). В клетках, лишенных FMNL2, накапливались везикулы с ANGPTL4.
В заключение авторы продемонстрировали, что транспорт ANGPTL4 зависит от FMLN2 и актина. С помощью флуоресцентных меток для всех трех белков они показали их коэкспрессию (близкое расположение в клетке). Тем самым была доказана роль FMLN2 в TGFβ-индуцированной экспрессии проопухолевого белка ANGPTL4: TGFβ активирует FMLN2, тот, в свою очередь, полимеризует актин, что «подталкивает» везикулы на правильный секреторный путь. Понимание этого механизма может помочь в регуляции метастазирования и опухолевой прогрессии.
Источник
Frank, D., et al. Vesicle-Associated Actin Assembly by Formins Promotes TGFß-Induced ANGPTL4 Trafficking, Secretion and Cell Invasion // Advanced Science. 2023: DOI: 10.1002/advs.202204896


 Меню
Меню





 Все темы
Все темы




 0
0








