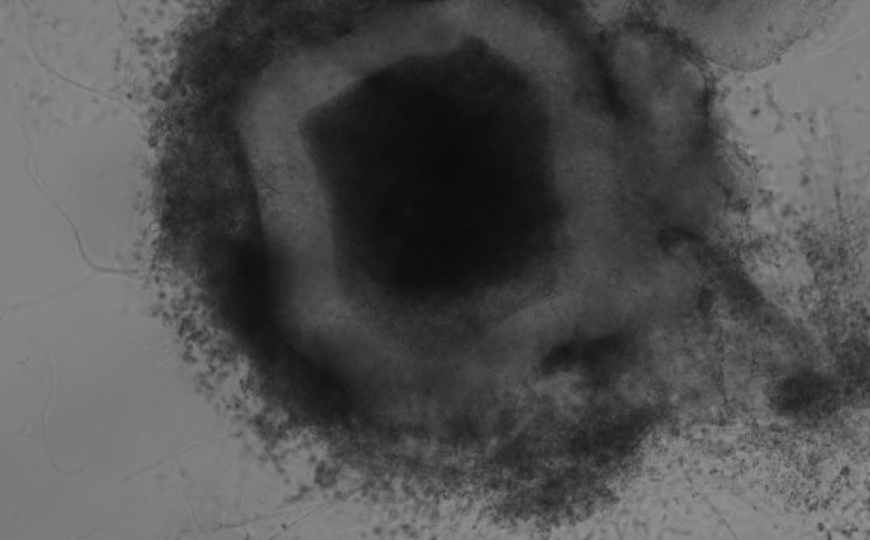
Биопечать опухолевых органоидов поможет быстро выявить чувствительность к лекарствам
Ученые из США создали новый протокол для получения и изучения опухолевых 3D-органоидов, основанный на биопечати, интерферометрии живых клеток и машинном обучении. Такой подход позволяет получать органоиды в большом количестве и с гарантированным качеством. Также впервые стал возможен автоматизированный анализ ответа 3D-культур на лекарственные препараты.
Высокопроизводительный скрининг лекарственных препаратов часто производится на двумерных культурах, которые не могут точно отразить сложную архитектуру и биологию опухолей. Для решения этой проблемы американские ученые разработали алгоритм, использующий биопечатные опухолевые органоиды в сочетании с высокоскоростной интерферометрией живых клеток (HSLCI) и машинным обучением. Этот подход позволяет фиксировать переходные изменения и гетерогенность, что дает представление об ответе и резистентности к терапии. Биопринтинг сохраняет гистологию опухоли и экспрессию генов, а HSLCI и машинное обучение позволяют измерять массу без биологических меток или маркеров для тысяч органоидов. Эта стратегия быстро определяет органоиды, чувствительные или устойчивые к определенным методам лечения, что помогает в выборе подходящей терапии.
HSLCI — это передовой метод визуализации, который позволяет проводить мониторинг живых клеток и тканей в режиме реального времени без использования меток или красителей. Метод использует интерферометрические принципы для определения изменений длины оптического пути, вызванных клеточными структурами и процессами. HSLCI предоставляет количественную информацию высокого разрешения о морфологии, динамике и реакции клеток на стимулы (например, лекарственные препараты).
На первом этапе авторы разработали протокол для создания опухолевых 3D органоидов. Они использовали биопринтер для автоматического посева клеток. В качестве основы была использована платформа для скрининга органоидов, в которой органоиды выращиваются из клеток, посеянных в мини-кольца матригеля по краям 96-луночных планшетов. Смесь клеток и матригеля переносилась в картридж для печати и наносилась в каждую лунку под давлением, после чего получались квадратные отпечатки размером менее 200 мкм на стандартных планшетах со стеклянным дном.
Далее авторы оптимизировали процедуру для дальнейшего анализа органоидов с платформой HSLCI, для которой важна плотность анализируемой биомассы. Так, были созданы более тонкие слои матригеля с помощью увеличения гидрофильности поверхности 96-луночных планшетов со стеклянным дном путем обработки кислородной плазмой. Наконец, авторы подтвердили, что используемые параметры печати не изменили жизнеспособность клеток, сравнив выживаемость клеток MCF-7, посеянных вручную, с клетками, посеянными с помощью биопринтера с заданными параметрами.
Чтобы убедиться, что биопечать не нарушает биологию опухоли, авторы напрямую сравнили гистологические и иммуногистохимические профили биопечатных и посеянных вручную клеток из двух клеточных линий рака молочной железы (BT-474 и MCF-7). Биопечатные клетки и органоиды были морфологически неотличимы от посеянных вручную. Все кластеры клеток увеличивались в размерах с течением времени, биопечать не изменяла их скорости пролиферации (проверили окрашиванием на Ki-67) или апоптоза (окрашивание на каспазу 3).
На следующем этапе исследователи сравнили молекулярные характеристики биопечатных и посеянных вручную клеток. Так, транскриптомный анализ клеток, посеянных двумя разными подходами, не выявил существенных различий на уровне РНК. Кроме того, разницы не было обнаружено и на уровне изменений в альтернативном сплайсинге. Таким образом, авторы заключают, что биопринтинг не оказывает влияния на молекулярные характеристики клеток.
После того, как органоиды выращены (на третий день после посадки клеток), протокол подразумевает замену клеточной культуральной среды на среду, содержащую лекарственные препараты, и перемещение органоидов в инкубатор для HSLCI. HSLCI позволяет получать непрерывные изображения органоидов в течение 72 часов после начала действия препаратами. После этого жизнеспособность клеток оценивается с помощью анализа высвобождения АТФ. Обработка данных включает сегментацию изображений с использованием нейронных сетей, которая точно идентифицирует органоиды и удаляет артефакты, после чего измеряются размер и массу органоидов. Такой подход позволяет анализировать реакцию органоидов на противоопухолевые препараты с помощью HSLCI и машинного обучения на уровне индивидуальных органоидов. Так, было показано, что клетки MCF-7 изначально были крупнее клеток BT-474, и эта разница в размерах сохранялась на протяжении всего периода визуализации. Кроме того, авторы наблюдали, что обе клеточные линии росли медленнее в 3D-культурах, чем в 2D. Эти результаты демонстрируют пользу HSLCI для изучения поведения клеток и органоидов.
Затем ученые протестировали эффективность разработанного протокола для измерения ответа органоидов на противоопухолевую лекарственную терапию. Для этого были использованы препараты стауроспорин, неселективный ингибитор протеинкиназы с широкой цитотоксичностью, нератиниб, необратимый ингибитор тирозинкиназы, таргетирующий EGFR и HER2, и лапатиниб, обратимый ингибитор тирозинкиназы, также таргетирующий EGFR и HER2. HSLCI-анализ органоидов продемонстрировал значительное снижение массы кластеров BT-474 и MCF-7, обработанных нератинибом и стауроспорином соответственно, по сравнению с контролем.
Затем исследователи продемонстрировали, что сочетание HSLCI с машинным обучением обеспечивает высокопроизводительное отслеживание отдельных клеточных кластеров и органоидов, позволяя количественно оценить гетерогенность ответа на препараты внутри одних и тех же образцов. При лечении лапатинибом и нератинибом органоиды BT-474 были более чувствительными. Напротив, органоиды MCF-7 продемонстрировали меньшую чувствительность. Эти результаты указывают на различные модели ответа двух клеточных линий.
Кроме того, часть клеток во всех комбинациях не реагировала на тестируемые препараты. Эти клетки росли с той же скоростью, что и контрольная группа, и составляли значительную часть (от 7,8% до 87,1%) всех органоидов, в зависимости от клеточной линии и используемого препарата. Например, в кластерах клеток MCF-7, обработанных 10 мкМ лапатиниба, 37,7% клеток продолжали расти через 72 часа, а еще 10% сохраняли стабильную массу. Аналогично, в клетках BT-474, обработанных 10 мкМ нератиниба, почти 8% сохранили свою массу, и эта доля увеличилась до более чем 25% при воздействии 10 мкМ лапатиниба. Эти результаты свидетельствуют о наличии устойчивой популяции клеток, которую можно быстро выявить с помощью визуализации HSLCI. Эти клетки могут служить ценной моделью для изучения устойчивости к терапии.
Наконец, анализ высвобождения АТФ подтвердил чувствительность обеих клеточных линий к стауроспорину и снижение жизнеспособности клеток BT-474, обработанных 0,1 мкМ лапатиниба и 0,1 мкМ нератиниба в течение 72 часов. Эти результаты соответствовали тенденциям, наблюдаемым с помощью HSLCI в течение шести часов. Тем не менее, анализ АТФ может не отражать изменчивость, наблюдаемую в образцах, как это было выявлено с помощью HSLCI.
Органоиды использовали для подбора индивидуальной терапии колоректального рака
Источник:
Tebon P., et al. Drug screening at single-organoid resolution via bioprinting and interferometry // Nature Communications. Published online 6 June 2023, DOI: 10.1038/s41467-023-38832-8


 Меню
Меню





 Все темы
Все темы



 0
0