Брассиностероиды управляют ростом растений за счет ремоделирования клеточных стенок
Новая статья в Science посвящена росту карликовой разновидности Utricularia gibba — водного хищного растения, а также Arabidopsis thaliana. Работа помогла понять, что в рост всего растения вносит ограничение рост его эпидермиса, и важную роль в этом процессе играют фитогормоны брассиностероиды.
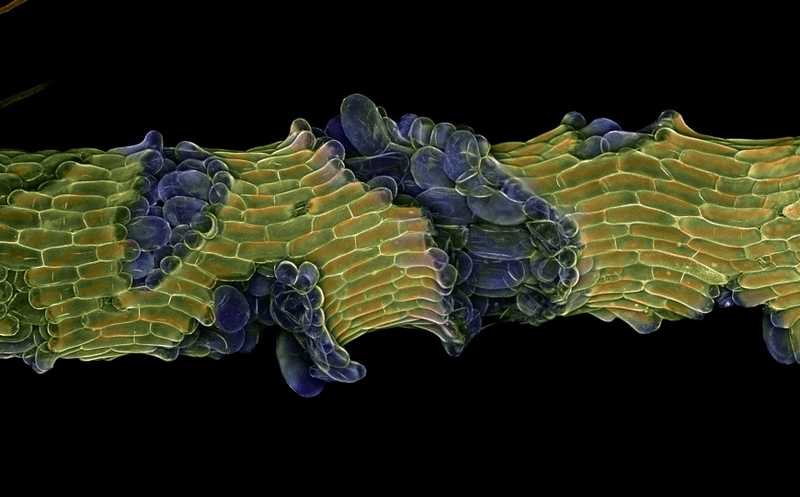
Для роста многоклеточного организма необходима координация между слоями его клеток. Ее могут обеспечивать как химические, так и механические стимулы, причем во втором случае неясно, как в этом участвуют гены. В новой статье журнала Science ученые из Великобритании и Китая установили, как гены, участвующие в работе фитогормонов брассиностероидов, могут усилить рост тканей стебля. Оказалось, для этого необходимо уменьшить ограничивающее действие эпидермиса, который ведет себя подобно «смирительной рубашке» и лимитирует рост всего растения.
Связь механического напряжения стебля и регуляции роста растений изучал еще Чарльз Дарвина, однако в этом вопросе по-прежнему многое неясно. Физиологам растений давно известно, что эффект механического воздействия на растительную ткань может быть опосредован тканевым стрессом. Так, если рост эпидермиса запаздывает, то но на клетки центральной части стебля механически воздействует как их собственный тургор, так и давление со стороны эпидермиса — тканевый стресс (tissue stress). Он порождает своеобразный «конфликт роста» между соседними слоями клеток и ограничивает размер всего растения.
В качестве объекта исследования авторы выбрали Utricularia gibba — хищное водное растение, которое держится на поверхности водоемов благодаря полостям с газом в столонах и листьях. Второе исследованное растение —Arabidopsis thaliana.
Чтобы получить мутантные формы U. gibba, авторы использовали индуцированный этилметансульфонатом мутагенез. Его применили к небольшим эксплантам из столонов.
Среди мутантов отмечены самые разные фенотипы: с измененными или отсутствующими ловчими камерами, нарушениями роста органов и т.д. Среди таких U. gibba были карликовые и «сверхкарликовые» растения, имеющие более мелкие органы и общий размер.
У низкорослых мутантов длина междоузлий достигала только 0,7 и 0,3 мм против 2 мм у растений дикого типа. В то же время клетки их эпидермиса были короче и в целом мельче. Показано, что на 70% этот эффект вызван замедлением продольного роста после прекращения клеточного деления. При этом у растений-карликов утолщаются столоны и увеличена плотность эпидермальных клеток на срезе. Это означает, что вторичный рост стебля (в ширину) до прекращения делений клеток был напротив, активнее.
Изучение внутренних тканей показало, что карликовые U. gibba имеют меньшие полости с газом, закрученные лучи тканей и искаженные проводящие пучки. У суперкарликовых растений два последних признака были выражены меньше. Такая морфология формируется уже после образования газовых полостей и свидетельствует о нарушении либо дифференциации клеток, либо их последующего роста.
Авторы создали компьютерную модель роста U. gibba на основе механики сплошной среды, рассмотрев два типа регионального роста. Первый — заданный рост — определяется только тургором самой клетки и не предполагает воздействие извне. Второй — результирующий рост — происходит в условиях тканевого стресса и предусматривает давление со стороны других клеток.
Рассмотрена модель небольшого столона U. gibba с жестким эпидермисом, к которому подходят лучи тканей от сердцевины. Узнаваемый карликовый фенотип в модели возникал, если скорость роста эпидермиса была равна нулю. В отсутствие полостей с газом закручивание проводящих пучков не было отмечено.
Далее авторы установили молекулярные механизмы, стоящие за формированием карликового фенотипа растений. Они секвенировали геномы 33 образцов U. gibba дикого типа, десять карликовых и три сверхкарликовых растения. Удалось выявить всего один однонуклеотидный полиморфизм, отличающий мутантов, в гене DWARF. Мутация вносит преждевременный стоп-кодон в гене, кодирующем фермент 90B1 (цитохром P450). Он катализирует альфа-гидроксилирование по положению C22 в метаболическом пути, который синтезирует брассиностероиды. Это стимулирующие рост фитогормоны, определяющие ответ растения не стресс и его иммунитет.
Мутации DWARF нарушают синтез брассиностероидов, что и вызывает карликовость. Гомолог этого гена (dwf4) имеется и у A. thaliana — опыты на этом растении показали, что ингибирование пути биосинтеза брассиностероидов вызывают схожий карликовый фенотип, а «заместительная терапия» фитогормоном делает растение нормальным. Ученые заключают, что DWARF необходим для синтеза брассиностероидов.
Исследования времени активности этого гормона указали, что он работает до момента образования пятого междоузлия. В норме это момент прекращения продольного роста клеток.
Также авторы попытались воспроизвести у A. thaliana тканевой стресс за счет мутаций в гене dwf4. Они также использовали мутации qua2-1, которые нарушают клеточную адгезию и вызывают трещины в эпидермисе. При этом стоит учитывать, что наземное растение устроено иначе — от U. gibba его отличает плотный, лишенный полостей стебель.
Скрещивание A. thaliana с мутациями dwf4 и qua2-1 создало новый фенотип: карликовый без эпидермиса. Изучение проростков гибридов показало, что трещины образуются на них только на третий день, а к пятому дню эпидермиса на них уже не заметно вовсе. Эксперименты также показали, что данный механизм действия фитогормонов связан с ремоделированием клеточных стенок растения.
Измерено содержание ионов в разных типах растительных клеток
Источник:
Kelly-Bellow R., et al. Brassinosteroid coordinates cell layer interactions in plants via cell wall and tissue mechanics // Science (2023), Vol. 380, Issue 6651, pp. 1275–1281. Published: 22 June 2023. DOI: 10.1126/science.adf0752


 Меню
Меню





 Все темы
Все темы




 0
0








