Escherichia coli транспортирует препарат в опухоль
Метод локализованной терапии рака найден на стыке иммунотерапии и синтетической биологии. В качестве доставщика лекарства выступает генно-инженерный штамм Escherichia coli.
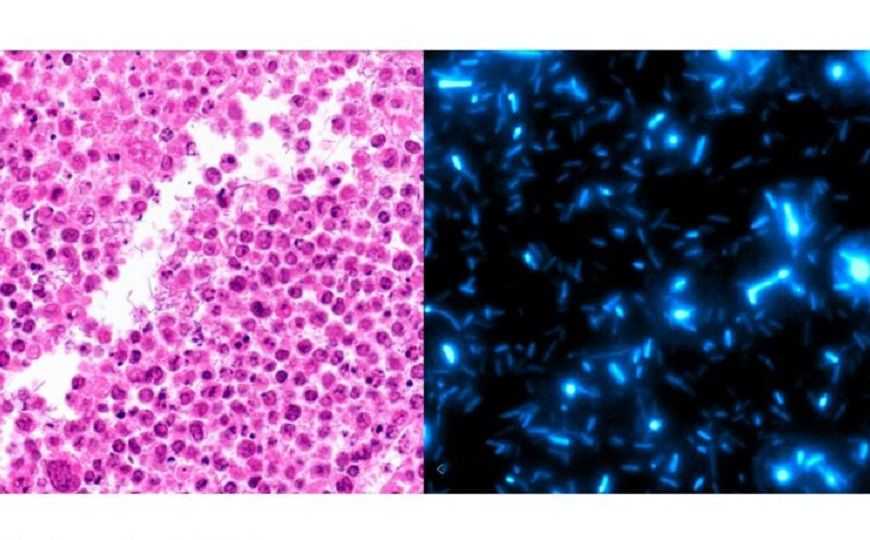
Бактерии, растущие в областях некроза лимфомы (слева). Бактерии, запрограммированные на прохождение волн роста и самоуничтожения, приводящих к высвобождению иммунотерапевтического препарата (справа).
Изображение: Danino Lab/Columbia EngineeringИммунотерапия рака эффективна для некоторых вариантов солидных опухолей, однако длительное ее применение вызывает значительные побочные эффекты. Синтетическая биология дает возможность генетически запрограммировать микроорганизм на работу в интересах человека. Группа ученых из Университета Колумбия совместила два направления и сконструировала систему для доставки иммунотерапевтических препаратов на основе непатогенного штамма бактерии Escherichia coli.
В качестве мишени для терапии был выбран белок CD47 — рецептор, защищающий клетки опухоли от фагоцитоза. Однако этот рецептор экспрессируется не только в опухоли, но и в клетках крови, и его системное ингибирование может вызвать анемию и тромбоцитопению. Это препятствие можно преодолеть, обеспечив доставку терапевтического препарата локально в опухоль.
Ученые создали штамм E. coli, который одновременно несет две плазмиды с нужными генами. Первая плазмида кодирует схему синхронного лизиса клеток (eSLC) — в ней зашит ген фермента лизиса бактерий (от бактериофага φX174) и ген, отвечающий за чувство кворума — способность бактерий к координированным действиям через молекулярные сигналы. Бактерии с такой плазмидой продуцируют молекулу чувства кворума — ацилгомосеринлактон. Когда концентрация этого вещества в среде достигает порогового значения, они синхронно начинают производить фермент лизиса, оболочка разрушается, бактерии гибнут.
Вторая плазмида несет ген, кодирующий наноантитела — антагонисты CD47 (CD47nb). Когда клетки лизируются, антитела высвобождаются и воздействуют на опухоль. Поскольку небольшая часть бактерий не погибает, цикл повторяется: E. coli размножаются, нарабатывают антитела-антагонисты, затем синхронно погибают и высвобождают лекарство и так далее.
Для эксперимента использовали мышиную модель лимфомы. Штамм eSLC–CD47nb вводили в опухоль. Мыши, получавшие лечение eSLC–CD47nb, демонстрировали быстрое и устойчивое сокращение опухоли и отсутствие метастазов в печени. 80% этих мышей прожили более 90 дней с начала эксперимента и были устойчивы к повторным инъекциям клеток лимфомы, в то время как у мышей из контрольной группы опухоль развивалась в течение недели после инъекции. Терапия eSLC–CD47nb была эффективна не только для лимфомы, но и для моделей рака груди и меланомы. При внутривенном введении штамма eSLC–CD47nb в организм мыши бактерии локализовались в опухоли, минуя печень, селезенку и почки, что говорит о безопасности такого метода лечения.
Авторы установили, что присутствие eSLC–CD47nb усиливает эффекторные функции Т-клеток как в опухоли, колонизированной бактериями, так и в очагах, не подвергавшихся направленной терапии, то есть был зафиксирован так называемый «эффект свидетеля». Это открытие говорит об установлении сильного опухолеспецифичного адаптивного иммунного ответа, который позволяет системно уничтожать отдаленные метастазы и таким образом способствует устойчивой ремиссии.
Данное исследование демонстрирует эффективный и безопасный подход к лечению солидных опухолей, способствующий не только быстрому сокращению опухоли, но и выработке системного противоопухолевого иммунитета. Относительная простота генной инженерии E. coli дает возможность конструировать штаммы, экспрессирующие комбинации различных иммунотерапевтических соединений. Авторы продолжают экспериментальную проверку концепции, а также проверку безопасности и токсикологические исследования штамма eSLC–CD47nb. В случае положительных результатов следующим шагом станут клинические испытания.
Источник
Chowdhury et al. // Programmable bacteria induce durable tumor regression and systemic antitumor immunity. // Nature Medicine, 2019; DOI: 10.1038/s41591-019-0498-z


 Меню
Меню





 Все темы
Все темы




 0
0