Генотерапевтический кошачий контрацептив
Основной способ контроля размножения домашних кошек — их хирургическая стерилизация. На смену ей ученые предлагают более безопасный и неинвазивный подход. Экспрессия рекомбинантного антимюллерова гормона, ген которого доставляется с помощью однократной инъекции, способна в течение как минимум двух лет предотвращать овуляцию у домашних кошек, не вызывая значимых побочных эффектов.

По современным оценкам, около 480 млн домашних кошек так или иначе оказываются «на свободном выгуле». Это осложняет контроль размножения животных. Основным методом в настоящий момент является стерилизация самок хирургическим путем, однако все еще ведется поиск эффективных и малозатратных альтернатив.
Авторы недавней публикации в Nature Communications предложили искусственно повышать экспрессию антимюллерова гормона (АМГ) у кошек, чтобы подавлять овуляцию на протяжении долгого времени. Предыдущие исследования на мышах показали, что искусственное превышение физиологического уровня АМГ у самок подавляло фолликулогенез и тем самым обеспечивало перманентную контрацепцию. Высокий уровень экспрессии этого белкового гормона при этом обеспечивался генотерапевтическим путем — ген АМГ доставляли при помощи аденоассоциированного вируса (AAV). Аналогичным подходом авторы воспользовались и в этой разработке — ген рекомбинантного кошачьего АМГ (авторы назвали варианты этого трансгена fcMIS) доставляли в векторном конструкте на основе AAV9. Этот серотип аденоассоциированных вирусов обладает тропизмом преимущественно к скелетной мускулатуре и характеризуется низким уровнем иммуногенности для кошек. Иными словами, в организме кошек исходно присутствует мало антител, специфичных к AAV9, поэтому он с намного меньшей вероятностью вызовет реакцию иммунной системы.
Безопасность первого поколения (fcMISv1) конструкта авторы испытали на трех самках домашней кошки. После однократного внутримышечного введения у животных не отмечалось побочных эффектов, таких как повышение температуры или признаки болевых ощущений в области инъекции. Уровень C-реактивного белка в крови, указывающий на воспалительные процессы, незначительно возрос в первую неделю после введения препарата и затем вернулся в норму.
Исследователи мониторили уровень АМГ (эндогенного и рекомбинантного) и антител к fcMISv1 в течение четырех лет после введения. У одной из кошек антител не наблюдалось, а общий уровень АМГ в сыворотке крови сохранялся высоким. Еще две кошки дали иммунный ответ — количество АМГ в их крови было ниже, при этом обнаруживались антитела к fcMISv1. Последующая гистология яичников после стерилизации 42 месяца спустя показала — при иммунной реакции также развивалась гиперплазия эндометрия, а у одной из кошек также обнаружили желтые тела в яичниках, что указывает на случаи овуляции. Заключив, что такой уровень иммуногенности слишком снижает эффективность долгосрочной контрацепции, авторы работы модифицировали последовательность рекомбинантного АМГ.
Испытания полученного конструкта, названного fcMISv2, проводили на более крупной выборке. Девять самок Felis catus разделили на три равных группы — в одной животные получали низкую дозу AAV9-fcMISv2 (5 x 1012 векторных геномов на кг массы тела), во второй высокую (1013 векторных геномов на кг), третья группа служила контролем и получала пустые частицы вирусного вектора (5 x 1012 вирусных частиц на кг). Первые две недели после внутримышечной инъекции физиологическое состояние кошек оценивали ежедневно. За исключением одного случая кратковременного местного отека у кошки, получившей высокую дозу, побочных эффектов выявлено не было.
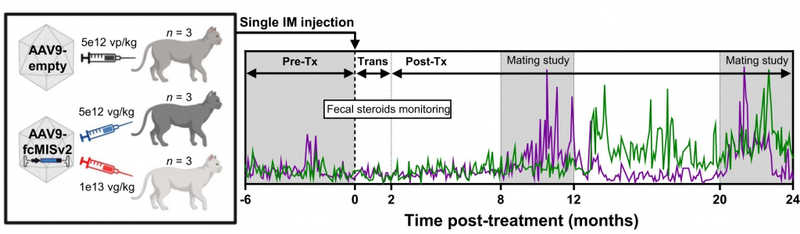 Схема испытания fcMISv2. Анализ уровня гормонов у трех групп кошек проводили в течение 6 месяцев перед инъекцией (Pre-Tx), следующие два месяца обозначили как переходный период, в течение которого экспрессия трансгена стабилизируется (Trans), после чего в течение 22 месяцев эффективность генотерапевтического контрацептива при спаривании кошек (Mating study, дважды с интервалом в год). Зеленым на графике обозначен уровень экскретируемого эстрадиола, фиолетовым — прогестерона.
Схема испытания fcMISv2. Анализ уровня гормонов у трех групп кошек проводили в течение 6 месяцев перед инъекцией (Pre-Tx), следующие два месяца обозначили как переходный период, в течение которого экспрессия трансгена стабилизируется (Trans), после чего в течение 22 месяцев эффективность генотерапевтического контрацептива при спаривании кошек (Mating study, дважды с интервалом в год). Зеленым на графике обозначен уровень экскретируемого эстрадиола, фиолетовым — прогестерона.Credit: Nature Communications (2023). DOI: 10.1038/s41467-023-38721-0 | CC BY
В более долгосрочной перспективе ученые также проводили биохимический анализ крови испытуемых кошек, чтобы оценить состояние почек, печени и скелетной мускулатуры. Маркеров их повреждения выявлено не было. Концентрация АМГ в крови кошек, получавших исследуемый конструкт, постепенно снижалась и выходила на плато ко второму году после инъекции, однако оставалась значимо повышенной в течение всего исследования. Иммуногенность fcMIS также была существенно снижена после оптимизации последовательности трансгена — в крови всех шести кошек, получавших fcMISv2, антител к рекомбинантному АМГ не детектировалось.
Влияние повышенных концентраций АМГ на репродуктивную систему сначала оценивали на гормональном уровне, а затем проверяли выраженность контрацептивного эффекта при спаривании кошек.
Первые два месяца после инъекции ученые обозначили как «переходный» период, необходимый для того, чтобы экспрессия трансгена стабилизировалась и вызвала физиологический эффект. В последующие месяцы, вплоть до 24-го после введения препарата, ученые измеряли уровень половых гормонов в организме кошек (эстрадиол и его экскретируемые метаболиты, тестостерон, прогестерон, ЛГ, ФСГ, ингибин A и В) для оценки потенциальных изменений гормонального цикла. Результаты долговременного исследования показывают, что повышенная концентрация АМГ не вызывала значимых отклонений от естественного цикла — по-видимому, популяция антральных фолликулов в яичниках кошек поддерживала его в пределах нормы. Разница наблюдалась только в лютеиновую фазу — ее частота, судя по уровню прогестерона, значимо снижалась у кошек, получавших высокую дозу AAV9-fcMISv2. Таким образом, механизм действия этого генотерапевтического кошачьего контрацептива заключался в подавлении овуляции и/или формировании желтого тела.
Авторы также дважды проводили плановую вязку кошек — через 8 и через 20 месяцев после начала исследования. В течение четырех месяцев к ним пускали фертильного самца, который находился с ними 8 часов в сутки и 5 дней в неделю. Все это время ученые фиксировали поведенческие реакции, а наступление беременности кошек отслеживали при помощи еженедельных УЗ-исследований. В обоих экспериментах все кошки контрольной группы успешно спарились с самцом, забеременели и родили 2–4 здоровых котят каждая. Кошки, получавшие контрацептив, значительно слабее демонстрировали половое поведение (в каждой из групп спариваться согласилась только одна кошка, а беременность после спаривания не наступила).
Полученные результаты подтверждают эффективность предложенного генотерапевтического средства контрацепции, а также объясняют предполагаемый механизм его действия. Долговременное подавление овуляции при помощи экспрессии АМГ предотвращает наступление беременности кошек, не нарушая при этом эстрогеновый цикл. Авторы надеются, что данный метод быстрой и неинвазивной долговременной контрацепции станет альтернативой хирургической стерилизации.
Препарат против вируса Эбола помог найти лекарство для кошек
Источник
Vansandt, L.M. et al. Durable contraception in the female domestic cat using viral-vectored delivery of a feline anti-Müllerian hormone transgene // Nat Commun 14, 3140 (2023). DOI: 10.1038/s41467-023-38721-0


 Меню
Меню





 Все темы
Все темы




 0
0