Графеновый наносенсор с клеточным рецептором обнаруживает хемокин в сыворотке крови
Биосенсоры, основанные на аффинном взаимодействии, — перспективное направление диагностики «у постели больного». Международная группа ученых предложила новую архитектуру сенсора, в котором аналит распознается не антителом или аптамером, а модифицированным мембранным рецептором. В отличие от аналогов, новый сенсор может распознавать хемокин-мишень в сыворотке крови без предварительной обработки образца.
Sci Adv. 2023. DOI: 10.1126/sciadv.adf1402 | CC BY-NC
Портативная диагностика нуждается в быстрых, чувствительных и селективных способах обнаружения аналита. Такую возможность предлагает биоэлектроника, в которой специальный белок-рецептор закреплен на проводящей подложке. После связывания лиганда электрохимические свойства биосенсора меняются, и эти изменения детектируются электротехникой.
Большая часть подобных подходов основана на инженерной стратегии bottom-up, то есть на искусственно созданных биомолекулах, которые распознают аналит (кусочках антител или аптамерах). Однако подобные технологии часто не дают сигнал постоянной интенсивности, кроме того, аптамеры в биологических жидкостях легко деградируются нуклеазами, а антитела отличаются высокой себестоимостью.
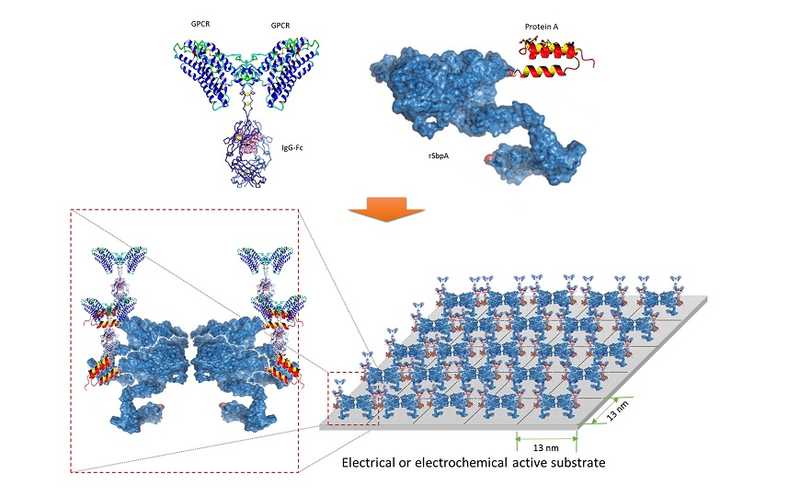
Команда инженеров из США, Германии, Австрии и Норвегии решила изменить стратегию на top-down подход и сконструировать биосенсор на основе уже имеющихся клеточных рецепторов. В качестве распознающего модуля они взяли рецептор хемокинов CXCR4 — мембранный белок из семейства рецепторов, связанных с G-белком (GPCR). Чтобы улучшить водорастворимость CXCR4, авторы мутировали белок по инструкциям алгоритма QTY. Затем, они с помощью константного домена иммуноглобулина G (IgG-Fc) и белка А нековалентно соединили рецептор с бактериальным белком SbpA, который способен связываться со графеновой подложкой и формировать жидкий кристалл на ее поверхности. Таким образом, исследователи получили графеновый биосенсор на основе CXCR4.
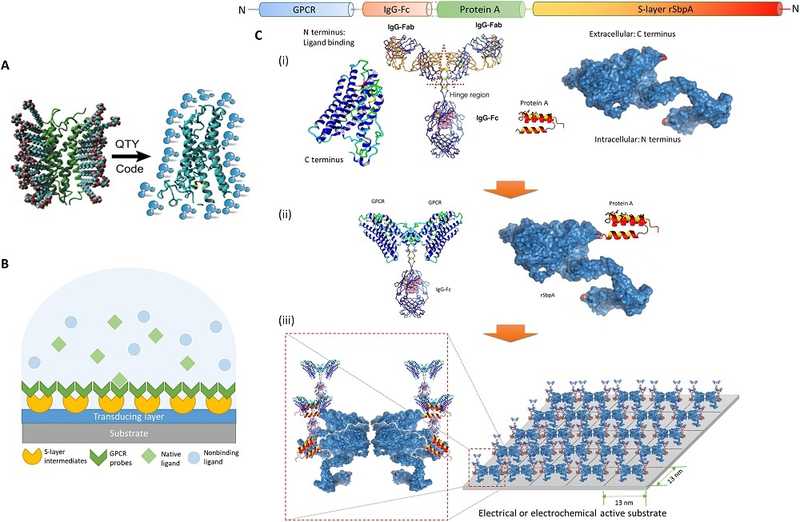 Архитектура и процесс сборки биосенсора. Пояснения в тексте. Credit: Sci Adv. 2023. DOI:
10.1126/sciadv.adf1402 |
CC BY-NC
Архитектура и процесс сборки биосенсора. Пояснения в тексте. Credit: Sci Adv. 2023. DOI:
10.1126/sciadv.adf1402 |
CC BY-NC
После этого ученые провели ряд биологических и аналитических тестов, чтобы протестировать новую конструкцию. В качестве аналита они выбрали естественный лиганд для рецептора — хемокин CXCL12. Авторы изучили структуру и работу сенсора с помощью программы AlphaFold2, а также методами кругового дихроизма и микроэлектрофореза. Дополнительно они продемонстрировали диссоциацию конструкции в кислом буфере (pH = 3) и возможность ее обратной сборки.
Подтвердив правильную структуру и связывание аналита, исследователи приступили к детекции лиганда в средах. Для начала они проверили работу своей системы в специальном буфере. Сигнал генерировался только в присутствии CXCL12 и был специфичным — если в растворе присутствовал хемокин CCL5, который не связывается с CXCR4, то сигнала не было.
Одним из преимуществ своей конструкции авторы считают повышенную стабильность биосенсора в биологических жидкостях. Чтобы это продемонстрировать, они поместили графеновую подложку с прикрепленными белками в сыворотку крови и не обнаружили никаких изменений в электрических свойствах биосенсора. Более того, GPCR рецептор смог детектировать наличие CXCL12 в неразбавленной сыворотке крови с чувствительностью и селективностью 100%.
Авторы считают, что новый подход поможет разработать альтернативу сенсорам на основе аптамеров и антител, так как рецепторы из семейства GPCR обладают огромным разнообразием биологических лигандов.
Электрохимический экспресс-тест выявляет однонуклеотидные полиморфизмы в крови
Источник
Rui Qing, et al. Scalable biomimetic sensing system with membrane receptor dual-monolayer probe and graphene transistor arrays // Science Advances. 2023. DOI: 10.1126/sciadv.adf1402


 Меню
Меню





 Все темы
Все темы




 0
0