Имплант с CAR-T клетками повысил их эффективность против B-клеточной лимфомы у мышей
Исследователи из США предложили оригинальную модификацию производства CAR-T-клеток: активация и перепрограммирование наивных Т-лимфоцитов происходит в пористом импланте, который затем подсаживают пациенту. Новая технология существенно снижает затраты, уменьшает время до начала лечения и втрое увеличивает выживаемость мышей с В-клеточной лимфомой через 100 дней.
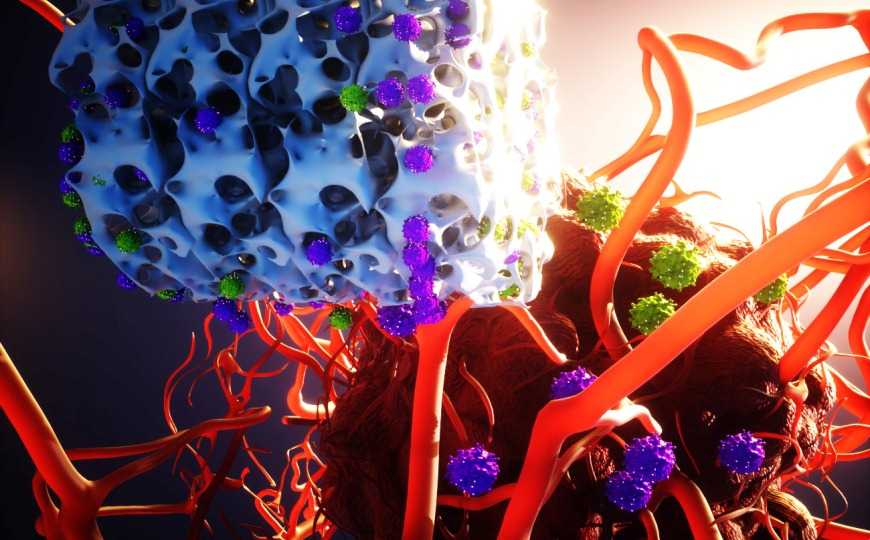
Имплантируемые каркасы MASTER включают вирусы и сигнальные факторы для быстрого и эффективного производства иммунотерапевтических CAR-T-клеток. Процесс, на который раньше уходили недели, протекает за несколько часов. После имплантации каркасы высвобождают CAR-T-клетки, чтобы они уничтожали опухоль в организме пациента.
Credit
Пресс-релиз | Ella Maru Studio
На протяжении многих лет для лечения большинства видов онкозаболеваний использовали стандартные подходы, такие как хирургическое удаление опухоли, лучевая терапия или химиотерапия. Не так давно этот список дополнила иммунотерапия — тип лечения, при котором для борьбы с заболеванием используют резервы иммунной системы пациента. Повышению значимости иммунотерапии способствовала разработка CAR-модифицированных T-клеток, нацеленных на раковые антигены. Собственные иммунные клетки пациента перепрограммируют за пределами его тела, чтобы у них появился химерный рецептор антигена (Chimeric antigen receptor — CAR), позволяющий охотиться на раковые клетки и разрушать их.
В частности, оказалась весьма успешной CAR-T терапия, например, лимфоидных новообразований В-клеточной природы. Однако у нее есть серьезные ограничения — недостаточная длительность, высокая стоимость и трудоемкость производства клеток ex vivo. Также существуют риски получения клеточных продуктов с гетерогенным составом, что снижает эффективность терапии. Чтобы преодолеть эти ограничения, ученые из Университета штата Северная Каролина и Университета Северной Каролины в Чапел-Хилле (США) создали уникальную методику производства CAR-модифицированных T-клеток in vivo — MASTER.
MASTER (Multifunctional Alginate Scaffolds for T-cell Engineering and Release) — это биосовместимый пористый материал из модифицированного альгината, впитывающий подобно губке наносимые на него наивные T-клетки пациента. В порах материала иммобилизованы антитела против рецепторов CD3 и CD28, обеспечивающие активацию этих клеток. Как только Т-клетки активируются, к ним добавляют гамма-ретровирусные частицы, несущие раковый антиген — таким образом происходит их перепрограммирование в CAR-T-клетки, нацеленные на борьбу с конкретным типом рака. Клетки также подвергают воздействию интерлейкинов, чтобы усилить их пролиферацию, после чего имплантируют MASTER в организм пациента.
Эффективность методики исследователи оценивали на мышах с B-клеточной лимфомой. Испытуемых животных разделили на две группы: мышей, получавших CAR-T-клетки с помощью MASTER, и мышей, получавших внутривенно CAR-T-клетки, созданные ex vivo. Эти две группы сравнивали с контрольной, получавшей необученные против лимфомы Т-клетки.
Через четыре недели после внедрения импланта ученые провели гистопатологическую оценку окружающих его тканей и биохимический анализ крови. Имплантация MASTER не вызвала значительных изменений.
В отдельной серии экспериментов in vitro проверили, могут ли ретровирусы, содержащиеся в импланте, трансдуцировать окружающие клетки пациента. Эту проверку проводили на культуре фибробластов — когда MASTER засеивали только вирусными частицами, несущими ген зеленого флуоресцентного белка (GFP), в фибробластах обнаруживали до 30% экспрессии GFP. Но когда помимо вирусных частиц в MASTER вводили мононуклеарные клетки периферической крови (PBMC), «утечки» вируса в окружающие клетки не происходило. Это позволило сделать выводы о том, что вирус трансдуцирует клетки только в непосредственной близости.
Подавление B-клеточной лимфомы в эксперименте было достигнуто: опухоли быстро росли у мышей, получавших контрольные нетрансдуцированные клетки, тогда как CAR-T-клетки, продуцируемые MASTER, и обычные CAR-T-клетки, вводимые внутривенно, в равной степени контролировали прогрессирование опухоли до 45-го дня без значительных изменений массы тела. Через 100 дней после внутривенного введения 4 млн CAR-T-клеток, полученных традиционным способом, наблюдалась 16,6%-ная безопухолевая выживаемость. Имплантация MASTER с 2 млн CAR-T-клеток увеличивала этот показатель до 50%.
Повышение противораковой эффективности было отмечено и в долгосрочной перспективе, когда у мышей начинались рецидивы лимфомы. Через 29 дней после первой ксенотрансплантации животные получали дополнительную дозу опухолевых клеток. В группе MASTER на протяжении 30 дней после этого не случилось рецидивов, тогда как у мышей, которым внутривенно вводили обычные CAR-T-клетки, в течение двух недель после повторной процедуры наблюдался значительный рост опухоли.
Преимущество MASTER может быть связано с двумя факторами. Во-первых, MASTER обеспечивает своего рода депо клеток, имплант высвобождает их постоянно. Во-вторых, поскольку CAR-T-клетки, генерируемые MASTER, не требуют наращивания популяции ex vivo, их клеточная популяция включает значительно больше Т-клеток памяти.
Важнейшее преимущество методики MASTER — значительное сокращение времени от получения Т-клеток до их терапевтического применения. «Обычно требуется не менее двух недель, чтобы создать CAR-T-клетки из наивных Т-клеток для клинического использования,— комментирует руководитель работы Евгений Брудно. — Мы смогли ввести MASTER мышам уже в течение нескольких часов после выделения наивных Т-клеток». Предполагается, что в будущем это позволит добиться ремиссии у пациентов в более сжатые сроки.
Источник
Agarwalla P., et al. Bioinstructive implantable scaffolds for rapid in vivo manufacture and release of CAR-T cells //Nature Biotechnology. 2022. DOI: 10.1038/s41587-022-01245-x
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








