Имплантация гидрогеля защищает от рецидива рака после операции
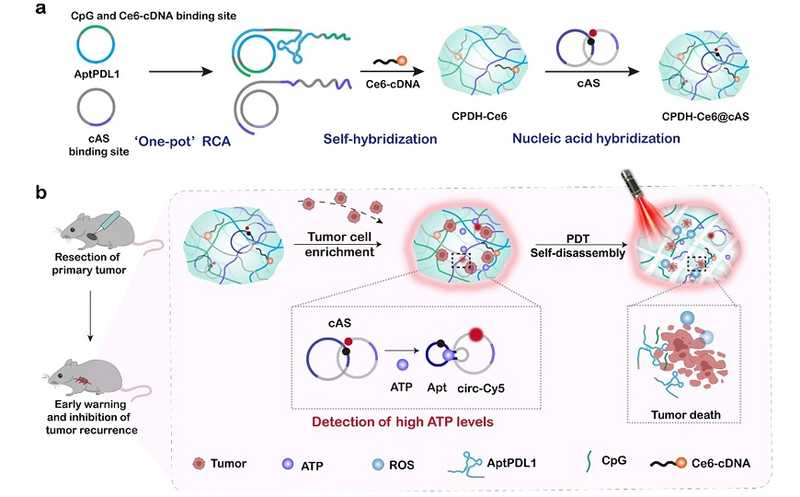
Исследователи из Китая предложили способ избежать рецидива и метастазирования солидных опухолей после их хирургического удаления с помощью гидрогеля, который имплантируется на место опухоли. PDL1-аптамеры в составе гидрогеля ловят и обогащают опухолевые клетки. Сенсор распознает присутствие клеток опухоли по локальному росту концентрации АТФ. После этого гидрогель можно облучить лазером, что приведет к уничтожению опухолевых клеток, выпуску антигенов и активации иммунной системы. В опытах на мышах гидрогель подавил рецидив и замедлил рост вторичной опухоли на 88,1% и 56,3% соответственно.
Danyu Wang, et al. Nature Communications (2023), DOI: 10.1038/s41467-023-40085-4 | СС 4.0
При возникновении солидных опухолей предпочтительнее всего попытаться удалить их хирургически, однако и в этом случае нередко возникают рецидивы. Их тяжело выявить обычными методами, так что довольно часто до этого момента успевают развиться метастазы. Химиотерапия и радиотерапия, которые назначают после операции, не всегда эффективны и имеют множество побочных эффектов. Необходимо развивать методы детекции рецидивов и предотвращения метастазирования.
В настоящее время рецидивы и метастазы определяют с помощью визуализации и мониторинга опухолевых биомаркеров. Однако визуализация иногда реагирует на воспаление после операции, а эндоскопия несет риск инфекции. С другой стороны, немногочисленность опухолевых клеток после рецидива затрудняет определение биомаркеров. Исследователи из Китая предложили обогатить опухолевые клетки in situ с помощью гидрогеля, что может помочь раньше выявить рецидив. Уничтожение таких клеток важно для контролирования метастазирования.
Гидрогели помещают в организм поле операции. Они обладают иммуномодулирующими свойствами и могут активировать противоопухолевый иммунный ответ. В новой работе ДНК-гидрогель содержал PDL1-аптамеры, которые ловят и обогащают опухолевые клетки. Это повышает локальную концентрацию АТФ. Кольцевой сенсор АТФ (cAS) закреплен на ДНК-гидрогеле; он сигнализирует о присутствии опухолевых клеток. В гидрогель также загружены фотосенсибилизатор Ce6 и иммунный адъювант CpG. Если детектируется сигнал сенсора, то локальное облучение лазером вызывает образование активных форм кислорода (АФК), повреждающих пойманные опухолевые клетки. Это высвобождает опухолевые антигены. В то же время АФК вызывает распад гидрогеля, что выпускает PDL1-аптамеры и CpG, дополнительно стимулируя иммунную систему. Таким образом, ДНК-гидрогель позволяет следить за появлением опухолевых клеток и активировать фотодинамическую иммунотерапию.
Исследователи синтезировали гидрогель CPDH-Ce6@cAS и улучшили его свойства. После этого они проверили его работу in vitro. Гидрогель с PDL1-аптамерами и без них инкубировали с клетками B16F10 (клетки мышиной меланомы), у которых PDL1 экспрессировался на высоком уровне. Эксперимент показал, что аптамеры играют ключевую роль в поимке и обогащении опухолевых клеток. Наличие большого числа опухолевых клеток увеличивало локальную концентрацию АТФ. Чем больше было клеток, тем интенсивнее был флуоресцентный сигнал, испускаемый АТФ-сенсором.
Затем авторы проверили работу гидрогеля CPDH-Ce6@cAS in vivo на мышах. Гидрогели различного состава имплантировали в частично иссеченную опухоль мышей in situ. Флуоресценцию оценивали в различные временные промежутки. Авторы показали стабильность cAS in vivo. Весь гель был стабилен в физиологических условиях in vitro в течение десяти дней, а in vivo — около недели.
Гидрогель имплантировали мыши на место полностью иссеченной опухоли, после чего вводили различное число опухолевых клеток. Число клеток положительно коррелировало с интенсивностью флуоресценции АТФ-сенсора. Причем сенсор отвечает на присутствие опухолевых клеток достаточно быстро, достигая максимума свечения через час.
Чтобы проверить терапевтический эффект гидрогеля на мышах, исследователи использовали меченные люциферазой клетки B16F10. Эти клетки вводили мышам в противоположную от первичной опухоли сторону груди. После того, как размер опухоли достигал 100 мм3, первичную опухоль частично иссекали, а на ее место имплантировали гидрогель. Гидрогель облучали лазером десять минут каждый день в течение пяти дней. Биолюминесцентный сигнал использовали, чтобы оценить рост опухоли.
Гидрогель значительно подавлял рецидив и замедлял рост вторичной опухоли (на 88,1% и 56,3% соответственно). Терапия не влияла на массу тела мышей. Окрашивание органов и регулярные анализы крови не выявили побочных эффектов терапии. В опухолях она вызывал некроз и апоптоз.
Через четыре дня после операции остаточные опухоли извлекали и анализировали. В них было много иммунных клеток (дендритных и T-клеток), что говорило об активации иммунной системы. Количество T-клеток повышалось также в легких, что может предотвратить развитие метастазов в этих органах.
У исследования были ограничения. Например, частичное иссечение опухоли и введение небольшого числа раковых клеток после операции не могут повторить процессы, возникающие при рецидиве. Также стабильность гидрогелей in vivo остается довольно низкой. Тем не менее, авторы считают свой подход многообещающим.
Сосуды из гидрогеля ведут себя, как настоящие, в опытах in vitro
Источник:
Danyu Wang, et al. Enrichment and sensing tumor cells by embedded immunomodulatory DNA hydrogel to inhibit postoperative tumor recurrence // Nature Communications volume 14, Article number: 4511 (2023), published July 27, 2023, DOI: 10.1038/s41467-023-40085-4


 Меню
Меню





 Все темы
Все темы




 0
0








