Импланты на основе крови ускоряют заживление травм
Успешная регенерация тканей после повреждения во многом зависит от различных факторов крови, способствующих нормальному процессу заживления. Воссоздание этих сложных условий — одна из задач современной регенеративной медицины. Ученые из Китая и Великобритании предложили изготавливать биосовместимые импланты из собственной крови пациента. Они напечатали из небольших объемов крови и амфифильных пептидов 3D-структуры и вживили их крысам с поврежденным черепом. Импланты стимулировали регенерацию и ускоряли восстановление кости.
Сборка амфифильных пептидов и компонентов крови в гель.
Credit:
Advanced Materials (2024). DOI:
10.1002/adma.202407156 |
CC BY
Для заживления поврежденных тканей очень важны компоненты крови, формирующие в области травмы так называемую регенеративную гематому. Это особая среда, содержащая основные клетки, макромолекулы и факторы, которые запускают и регулируют процесс регенерации. Одна из основных проблем современной регенеративной медицины — сложность искусственного воссоздания этих способствующих восстановлению условий. Использование многих подходящих биоматериалов, например, фибрина, затруднено необходимостью получения большого объема крови, ограниченностью механических свойств и другими сложностями.
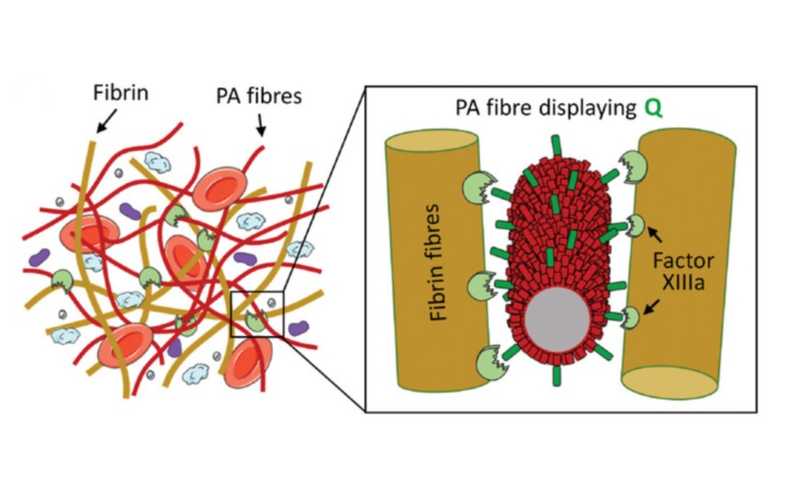
В качестве решения этой задачи ученые из Британии и Китая предложили использование амфифильных пептидов (АП) — молекул, способных связывать компоненты крови и собираться в наноструктуры в ходе коагуляции. Они изготовили АП с различной величиной положительного или отрицательного заряда и подтвердили их способность связываться с ключевыми компонентами крови — фибриногеном и альбумином, — которые играют важную роль в заживлении и формировании регенеративной гематомы. С помощью оптической и конфокальной микроскопии ученые наблюдали за диффузией флуоресцентно-меченых альбумина и фибриногена в раствор АП, что немедленно приводило к загустеванию при их взаимодействии. Добавление небольшого количества АП к человеческой крови также сразу приводило к гелеобразованию.
Далее АП немного изменили так, чтобы они могли собираться в нановолокна, на поверхности которых расположены остатки глутамина или лизина — мишени распознавания фактора свертывания крови XIIIa. Как и ожидалось, при внесении таких модифицированных АП в кровь образовывались более стабильные гидрогели, причем добавление к АП остатка глутамина усилило их механические свойства.
С помощью экструзионного 3D-принтера исследователи напечатали структуры из АП в крови — технология называется «жидкость в жидкости». Основываясь на усредненных характеристиках образцов крови и настраивая параметры процесса, такие как скорость подачи материала и давление, авторы напечатали объемную сетку, состоящую из АП и нановолокон фибрина. В образующихся при взаимодействии ПА и крови гелях присутствовали активированные тромбоциты и сокращенная фибриновая сеть, что соответствует процессу коагуляции и естественной регенерации.
По аналогии с естественной регенеративной гематомой, которая секретирует множество регулирующих воспаление и заживление факторов, из образующихся гелевых структур высвобождались различные цитокины и факторы роста, такие как IL-1α, IL-6, IL-10, TNF-α, TGF-β1, фактор стволовых клеток SCF, IGF-1 и VEGF. При этом гели, полученные на основе модифицированных глутамином АП, сохраняли с течением времени большее количество факторов, что, вероятно, связано с их более высокой структурной целостностью.
Полученные гелевые каркасы затем заселили фибробластами линии NIH-3T3, поскольку они широко используются в тканевой инженерии для оценки биосовместимости материалов, а также человеческими мезенхимальными и эндотелиальными стромальными клетками — они играют важную роль в клеточной дифференцировке и ангиогенезе при заживлении кости. Все исследуемые клетки хорошо приживались и пролиферировали, а эндотелиальные стромальные клетки даже организовались в трубчатые структуры к седьмому дню. Растворы АП успешно прошли тесты на биосовместимость, не приводя к свертыванию крови.
В экспериментах in vivo ученые создали импланты на основе АП с использованием крови крыс и внедрили их животным на шесть месяцев для восстановления повреждения черепа критического размера. Ни биохимический анализ крови, ни другие исследования не выявили никаких отклонений, которые могли бы свидетельствовать о токсичности — как острой, так и долгосрочной. Микрокомпьютерная томография показала, что у крыс с имплантами образование и заживление костной ткани шло более эффективно, чем при использовании коммерчески доступного натурального заменителя кости. Никаких признаков иммунного ответа также обнаружено не было.
Таким образом, ученые создали биоматериал, образующий при взаимодействии с кровью гели с регулируемыми механическими свойствами. Импланты на основе этого материала не обладают токсичностью и иммуногенностью; они способствуют высвобождению необходимых факторов роста и цитокинов, имитируя естественный процесс регенерации. Авторы надеются, что разработанный ими биоматериал найдет применение к клинической практике для создания аутологичных имплантов из собственной крови пациентов.
Электропроводящий гидрогель способствует регенерации поврежденных мышц


 Меню
Меню





 Все темы
Все темы




 0
0








