Как «отформатировать» стволовой клетке эпигенетическую память?
Работу с индуцированными плюрипотентными стволовыми клетками (iPSC) осложняет их эпигенетическая память — даже после перепрограммирования они способны сохранять эпигенетические черты своего исходного соматического состояния. Новая работа в Nature посвящена тому, как эту эпигенетическую память стереть, тем самым приближая iPSC к эмбриональным стволовым клеткам и расширяя возможности их применения.
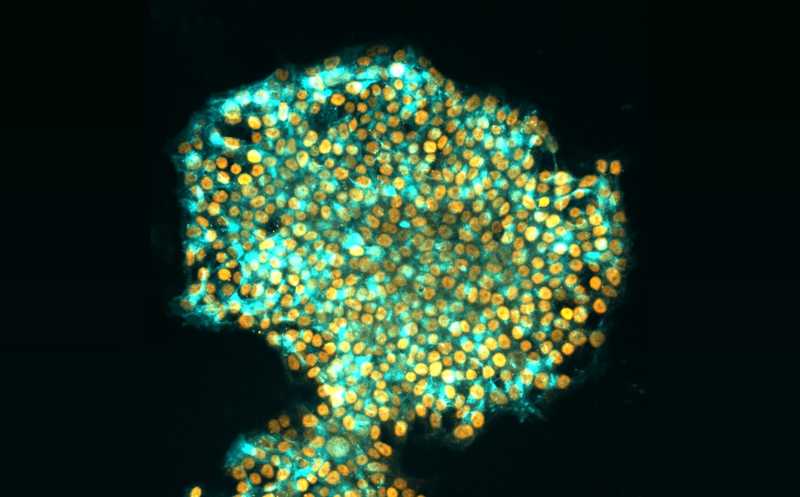
Индуцированные плюрипотентные стволовые клетки человека.
Credit:
Jia Tan, Polo laboratory |
пресс-релиз
Индуцированные плюрипотентные стволовые клетки (ИПСК) человека (hiPS) — мощный инструмент для моделирования многих процессов, происходящих в эмбриональных стволовых клетках (СК), перспективный и для клинической практики. При их получении происходит искусственная дедифференцировка соматических клеток, в ходе которой перестраивается эпигеном. Несмотря на это ремоделирование, эпигенетически iPSC могут сильно отличаться от эмбриональных стволовых клеток и потому хуже воспроизводить их свойства. Международный коллектив под руководством исследователей из Австралии охарактеризовал возникновение и поддержание таких эпигенетических различий, а также предложил способ преодолеть это затруднение.
Самый распространенный метод получения iPSC — экспрессия транскрипционных факторов OCT4, KLF4, SOX2 и MYC в культуре соматических клеток. При этом происходит дедифференцировка в т.н. «праймированные» стволовые клетки, которые соответствуют клеткам эпибласта после имплантации эмбриона. Модифицированные варианты этого подхода позволяют добиться перепрограммирования в наивные стволовые клетки, которые соответствуют более ранней стадии эмбриональных СК и характеризуются меньшим уровнем метилирования ДНК.
Исследователи перепрограммировали фибробласты человека и отследили профиль метилирования ДНК при их дедифференцировке в наивные или праймированные клетки. Для этого они отбирали промежуточные стадии по поверхностным маркерам и проводили полногеномное бисульфитное секвенирование параллельно с секвенированием РНК. Этот подход позволил ученым количественно охарактеризовать метилом перепрограммируемых клеток. Оказалось, что при получении праймированных iPSC метилирование меняется в основном на 13–21 день перепрограммирования, тогда как основные изменения в наивных стволовых клетках происходят до 13-го дня.
Ученые проанализировали не только метилирование CpG — наиболее изученную эпигенетическую метку — но и CpH. В таком варианте H обозначает любой нуклеотид ДНК, кроме гуанина (то есть A, C или T), а сама метка (чаще всего на CpA) служит эпигенетическим маркером плюрипотентных стволовых клеток. Оказалось, что метилирование CpA возрастает в течение первых пяти дней формирования наивных стволовых клеток, а в случае с праймированными уровень метилирования растет на 13-й день и позднее. Результаты транскриптомного анализа указывают на роль этих изменений: по-видимому, они служат для поддержания репрессии генов в целом, а не для регуляции экспрессии отдельных белков. Кроме того, исследователи провели секвенирование РНК единичных клеток разных вариантов iPSC. Анализ показал, что эпигенетические метки, которые сохраняются у праймированных iPSC, наследуются при дифференцировке и в ряде случаев снижают ее эффективность.
Авторы работы также изучили паттерны аномального гиперметилирования, которое свойственно только праймированным клеткам. В исследовании они сосредоточились на метилировании участков контроля импринтинга (ICR). Оказалось, что деметилирование в этих областях генома происходит тем сильнее, чем дольше клетки культивируются в условиях для перепрограммирования в наивные iPSC.
Следующим важным шагом стала разработка нового протокола получения плюрипотентных стволовых клеток, «очищенных» от эпигенетической памяти. Авторы проверили две экспериментальных системы. В первой из них они культивировали дедифференцирующиеся клетки в условиях для получения наивных iPSC в течение пяти дней, а оставшийся период выращивали их как праймированные клетки. Второй вариант включал сперва получение наивных iPSC, а затем формирование из них праймированных клеток. Первый вариант, получивший название TNT (от «transient-naïve-treatment), ученые сочли более эффективным.
Затем ученые задались целью сравнить эмбриональные СК со стволовыми клетками, полученными TNT-репрограммированием (TNT-hiPS), и с праймированными iPSC. К этой задаче авторы подошли комплексно: проанализировали уровень метилирования CpG и CpA-сайтов, доступность хроматина, экспрессию генов и мобильных элементов. Результаты анализа подтвердили, что TNT-hiPS с высокой точностью моделируют эмбриональные стволовые клетки, тогда как праймированные клетки отличаются от них на молекулярном уровне. Кроме того, полученные новым методом плюрипотентные СК легче дифференцировались в различные типы клеток: клетки скелетной мускулатуры, легочный эпителий, эндодермальные клетки, кортикальные нейроны и нейрональные стволовые клетки.
Разработанный исследователями метод дедифференцировки воспроизводит природные процессы, происходящие при формировании эмбриональных стволовых клеток. Такое перепрограммирование позволяет эффективно стирать эпигеномную память клеток при получении iPSC и улучшать их способность к дифференцировке. Авторы рассчитывают, что предложенный ими подход станет мощной модельной системой для изучения эпигенетической памяти и механизмов ее поддержания, а также найдет применение в клинической практике.
Что происходит при химическом омоложении клеток
Источник
Buckberry, S., et al. Transient naive reprogramming corrects hiPS cells functionally and epigenetically. // Nature (2023). DOI: 10.1038/s41586-023-06424-7


 Меню
Меню





 Все темы
Все темы



 0
0