Как заставить опухолевые клетки производить лекарства против самих себя
Ученые из Университета Цюриха создали аденовирусный вектор, который действует на опухолевые клетки по принципу «троянского коня»: проникает в них и заставляет синтезировать терапевтическое антитело против самих себя. В экспериментах на мышах концентрация антитела в опухоли при прямом введении аденовирусных частиц была в 1 800 раз выше, чем при внутривенном введении самого антитела.
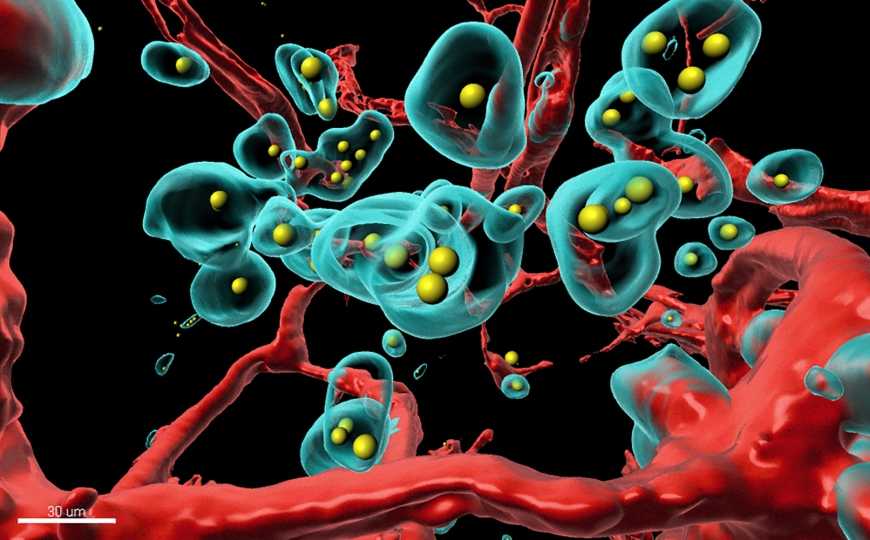
Credit: Plückthun Lab | Пресс-релиз
Исследователи из Университета Цюриха модифицировали аденовирусный вектор таким образом, чтобы он избирательно трансдуцировал опухолевые клетки, заставляя их производить терапевтические антитела. Если антитела вырабатываются самими раковыми клетками, они устраняют опухоль изнутри, поэтому авторы сравнивают новую платформу с троянским конем. В отличие от химиотерапии или лучевой терапии, этот подход не вредит нормальным здоровым клеткам.
Исследователи назвали свою платформу SHREAD: SHielded, REtargetted ADenovirus (экранированный и перенаправленный аденовирус). При ее создании использовались технологии, разработанные этой же командой ранее: биспецифический адаптор на основе анкириновых повторов (DARPins), позволяющий направить аденовирус в клетки с определенным поверхностным маркером, а также экранирование аденовирусной оболочки для защиты его от иммунного ответа.
С помощью системы SHREAD ученые направили вирус в HER2-экспрессирующие опухолевые ксенографты, пересаженные мышам. Аденовирусные частицы вводили непосредственно в опухоль. Конструкция содержала гены тяжелой и легкой цепей клинически одобренного для лечения рака груди антитела трастузумаб. Гены находились под сильным промотором CMV, между ними находился сайт расщепления фурином и саморасщепляющийся пептид 2a. Кроме того, в конструкцию включили ген eGFP в качестве репортера успешной трансдукции.
Ученые обнаружили, что через несколько дней после инъекции концентрация антитела в опухоли была в 1 800 раз выше, чем при внутривенном введении трастузумаба. Более того, концентрация терапевтических антител в кровотоке и других тканях была значительно ниже, что позволяет говорить о потенциально более низкой вероятности побочных эффектов от применения системы SHREAD. С помощью CLARITY — метода трехмерной визуализации с высоким разрешением — ученые сделали гистологический материал опухолей полностью прозрачным и показали, как терапевтическое антитело создает поры в кровеносных сосудах опухоли и, таким образом, уничтожает опухоль изнутри.
По словам авторов работы, в настоящее время они используют свою технологию в проекте, направленном на вакцинацию против COVID-19. «Доставка SHREAD в составе вдыхаемого аэрозоля сделает возможной производство терапевтических антител против COVID-19 в клетках легких, где они больше всего необходимы, — объясняет постдок Шена Смит, которая отвечает в этом проекте за направление доставки препарата. — Это снизит затраты, повысит доступность терапии COVID-19 и улучшит доставку вакцины с помощью ингаляционного подхода».
Источник
Smith, S. N., et al. // The SHREAD gene therapy platform for paracrine delivery improves tumor localization and intratumoral effects of a clinical antibody. // PNAS May 25, 2021 118 (21) e2017925118; DOI: 10.1073/pnas.2017925118
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0