Химерная мышь производит крысиные сперматозоиды
Инъекция плюрипотентных стволовых клеток крыс в зародыши стерильных мутантных мышей позволила получить мышей-химер с жизнеспособными крысиными сперматозоидами. Такие сперматозоиды могли оплодотворять крысиные яйцеклетки, однако эмбрион после этого не развивался.
Интересное решение проблемы сохранения исчезающих видов предложили ученые из Швейцарской высшей технической школы Цюриха. Авторы исследования, опубликованного в журнале Stem Cell Reports, планируют получать гаметы (яйцеклетки и сперматозоиды) редких видов из стволовых клеток в половой системе бесплодных химерных животных.
Получение яйцеклеток или сперматозоидов из стволовых клеток — крайне сложная задача. Модифицированные гаметы чаще всего оказываются менее жизнеспособными, чем клетки животного-хозяина, поэтому проигрывают им в конкуренции при оплодотворении.
Авторы задались вопросом, можно ли производить крысиные сперматозоиды в организме мутантной бесплодной мыши. Для проверки идеи ученые купили у австралийской компании Ozgene Pty Ltd. мужские мышиные эмбрионы Tsc22D3-KO, также известные как «GoGermline». У этих эмбрионов выключен ген Tsc22d3, необходимый для выработки сперматозоидов. Авторы ввели крысиные плюрипотентные стволовые клетки в эмбрионы мышей. В результате были получены химеры мыши и крысы.
«Мы были удивлены относительной простотой, с которой cмогли смешать два вида для получения жизнеспособных химер мыши и крысы. Эти животные выглядели здоровыми и нормально развивались», — говорит ведущий автор исследования биолог Ори Бар-Нур.
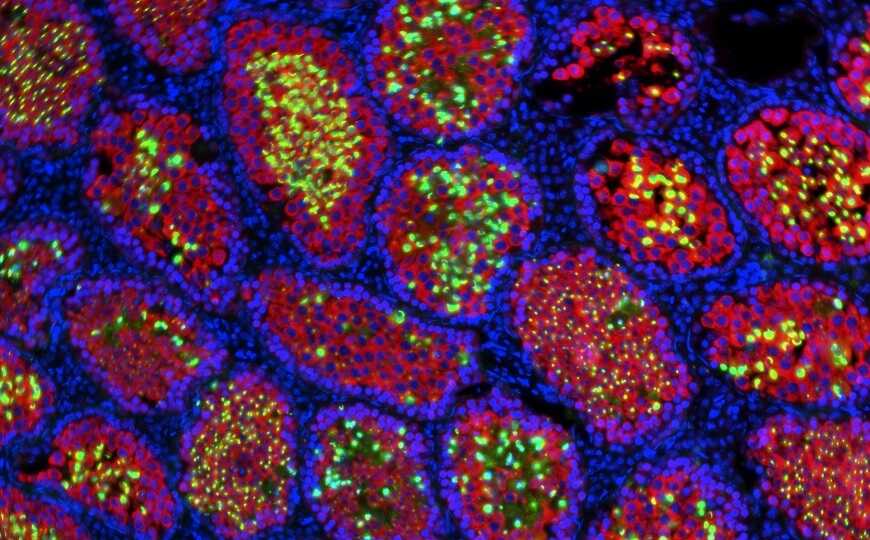
Плюрипотентные стволовые клетки крыс-доноров вводили в эмбрионы мутантных мышей на стадии бластоцисты. Использование метода бластоцистной комплементации позволило крысиным стволовым клеткам колонизировать неработающие семенники в межвидовом химерном эмбрионе, где начали вырабатываться исключительно крысиные сперматозоиды.
Таким образом, внутренняя среда половых органов самцов мышей, стерильных из-за генетической мутации, могла поддерживать эффективную выработку сперматозоидов другого вида. В частности, на поперечном сечении семенников химер были обнаружены интактные семенные канальцы, содержащие сперматозоиды, тогда как у мышей с мутацией в гене Tsc22d3 семенные канальцы были атрофированы.
Анализ результатов секвенирования транскриптомов отдельных клеток (scRNA-seq) показал, что в семенниках мыши с мутацией в гене Tsc22d3 содержались лейкоциты, эндотелиальные клетки и клетки Лейдига, но не было зародышевых клеток, а клеточный состав химерного семенника включал широкий спектр крысиных зародышевых клеток на разных стадиях сперматогенеза.
Экспериментальные сперматозоиды химер оказались жизнеспособны и могли оплодотворять яйцеклетки крыс, правда, это заняло у них больше времени, чем у обычных гамет. Полученные гаметы морфологически не отличались от сперматозоидов нормальных крыс, но были малоподвижными. К сожалению, в дальнейшем эмбрионы полноценно не развивались.
Авторы исследования предполагают две возможные причины неудачного эмбрионального развития потомства мышино-крысиных химер и обычных крыс: заморозка крысиных сперматозоидов до проведения процедуры оплодотворения и повреждение межвидовых гамет в ксеногенной среде тестикул мышей. Ученые намерены исключить одну из возможных причин и в следующих экспериментах использовать незамороженные зародышевые клетки, что, по их мнению, может увеличить шансы на нормальное оплодотворение и полноценное развитие.
Тем не менее, это исследование — первое доказательство возможности получения гамет одного вида в организме другого. В ближайшей перспективе исследователи хотят усовершенствовать технику проведения процедур и получить живых животных из сперматозоидов химер мыши и крысы. Кроме того, у ученых есть планы по созданию женских репродуктивных клеток в организме стерильной мутантной самки мыши.
Источники:
Zvick J., et al. Exclusive generation of rat spermatozoa in sterile mice utilizing blastocyst complementation with pluripotent stem cells // Stem Cell Reports, (2022), published online 4 August, 2022, DOI: 10.1016/j.stemcr.2022.07.005
Цитата по пресс-релизу.


 Меню
Меню





 Все темы
Все темы




 0
0








