Холод заставляет бурые адипоциты переключать АТФ-синтазу в режим гидролиза
Бурая жировая ткань обеспечивает несократительный термогенез. Международный коллектив исследователей установил, что один из механизмов его регуляции — это переключение АТФ-синтазы в «обратный режим», при котором она гидролизует АТФ. Такое переключение управляется белком IF1, высокие уровни которого замедляют митохондриальное дыхание. Под действием холода экспрессия этого белка в адипоцитах бурого жира снижается, и это способствует термогенезу.
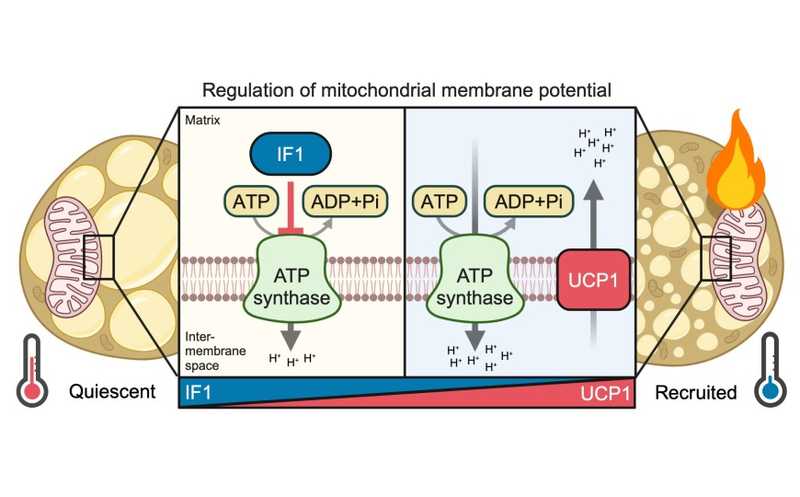
Холод усиливает несократительный термогенез за счет снижения экспрессии IF1 в адипоцитах бурого жира и, как следствие, перестройки метаболизма.
Credit:
EMBO J (2024). DOI:
10.1038/s44318-024-00215-0 |
CC BY
Одна из основных функций бурой жировой ткани — это несократительный термогенез. Он требует активации термогенина (UCP1), который разобщает митохондриальное дыхание и синтез АТФ. Регуляция этого механизма изучена достаточно хорошо, однако пока неясно, регулируется ли также активность F1Fo-АТФ-синтазы. Международный коллектив ученых показал на мышах, что ингибирование гидролитической активности АТФ-синтазы и переключение ее в «обратный режим», то есть в режим гидролиза АТФ, контролирует термогенез в адипоцитах бурого жира.
Для проверки работы АТФ-синтазы в клетках бурого жира исследователи содержали мышей при 4 °C в течение 5 дней. В таких условиях мыши потребляли больше пищи, чем при комнатной температуре, но все равно теряли массу тела. Воздействие холода почти вдвое усиливало гидролиз АТФ в бурой жировой ткани, причем его исходный уровень был низким. Митохондрии, выделенные из адипоцитов, «переключали» в обратный режим, добавляя к ним в среду АТФ. Гидролиз АТФ АТФ-синтазой за счет откачки протонов из матрикса в межмебранное пространство увеличивал мембранный потенциал митохондрий, причем это увеличение было более выраженным в митохондриях, подвергшихся воздействию холода. Авторы заключили, что низкие температуры увеличивают способность АТФ-синтазы в клетках бурого жира функционировать в обратном режиме.
В условиях, когда мембранный потенциал митохондрий или pH матрикса слишком снижается, происходит ингибирование гидролитической активности АТФ-синтазы при помощи IF1. Ученые предположили, что этот белок может регулировать функции АТФ-синтазы в буром жире под действием холода. Уровни мРНК Atp5if1, кодирующей IF1, снижались приблизительно на 50% после четырехчасового воздействия холода или агониста β3-адренорецепторов. Количество белка, соответственно, снижалось на 50% и 80% после трех и пяти дней воздействия холода. Количество АТФ-синтазы при этом не изменялось.
Оверэкспрессия IF1 в адипоцитах снижала их способность поддерживать мембранный потенциал митохондрий при стимуляции норадреналином. Это зависело от связывания IF1 с АТФ-синтазой — мутантная форма, неспособная с ней взаимодействовать, такого эффекта не оказывала. Избыточное падение мембранного потенциала, однако, прекращалось при нокдауне термогенина.
Затем исследователи проанализировали метаболические последствия сайленсинга IF1 в адипоцитах бурого жира. Он повышал скорость закисления, в том числе при стимуляции норадреналином, что косвенно указывает на бо́льшую зависимость таких клеток от аэробного гликолиза. Такое изменение не было связано с окислительным фосфорилированием или уровнями АТФ в клетке, однако соотношение АТФ/АДФ при нокдауне IF1 было ниже. По-видимому, при дефиците этого белка клетки испытывают умеренный энергетический стресс.
Изменения в утилизации глюкозы митохондриями могут влиять на окисление липидов. Этот процесс требует больше кислорода, чем окисление углеводов. Нокдаун IF1 несколько усиливал клеточное дыхание, и авторы решили проверить, насколько лишенные IF1 адипоциты зависят от липидов для поддержания дыхания. Анализ показал, что недостаток IF1 заставляет митохондрии утилизировать больше липидов и усиливает потребление кислорода, а компенсаторный механизм, по-видимому, стимулирует аэробный гликолиз для поддержания уровня АТФ в клетках.
Оверэкспрессия IF1, напротив, уводила бурые адипоциты в состояние покоя, замедляя митохондриальное дыхание.
Физиологическую роль IF1 ученые также проверили in vivo. In vitro оверэкспрессия IF1 заметно снижала клеточное дыхание, и потребление кислорода в буром жире мышей с повышенным уровнем этого белка также падало. Ингибирование термогенина с помощью ГТФ показало, что избыток IF1 затрудняет разобщенное митохондриальное дыхание. Разобщение митохондриального дыхания ослаблялось у таких мышей и при введении агониста β3-адренорецепторов. Повышение температуры тела в ответ на введение этого препарата также было менее выраженным при оверэкспрессии IF1.
Таким образом, оверэкспрессия IF1 подавляет митохондриальное дыхание и снижает термогенез в бурой жировой ткани. Снижение уровня этого белка в ответ на воздействие холода — адаптивный механизм, способствующий перестройке митохондриального и клеточного метаболизма для поддержания несократительного термогенеза.
Голые землекопы адаптируются к гипоксии, снижая температуру тела
Источник
Henver S Brunetta, et al. IF1 is a cold-regulated switch of ATP synthase hydrolytic activity to support thermogenesis in brown fat. // EMBO J (2024). DOI: 10.1038/s44318-024-00215-0


 Меню
Меню





 Все темы
Все темы



 0
0