Клинические испытания CAR-NK-терапии при CD19-положительном раке
В качестве более дешевой и простой альтернативы терапевтическим CAR-T-клеткам сейчас разрабатывают NK-клетки (естественные киллеры), также несущие химерный антигенный рецептор. CAR-NK, нацеленные на CD19, успешно проходят фазу I/IIa клинических испытаний.
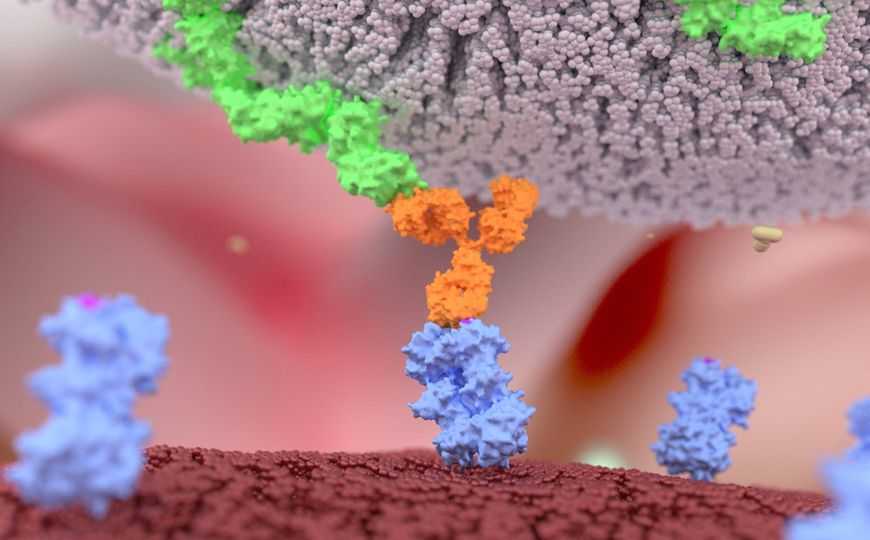
Использование Т-клеток, модифицированных химерными антигенными рецепторами (CAR-T-клеток), зарекомендовало себя как перспективный способ терапии онкологических заболеваний. В частности, CAR-T-клетки, нацеленные на B-лимфоцитарный антиген CD19, успешно применяют при остром В-лимфобластном лейкозе, хроническом лимфоцитарном лейкозе и неходжкинской лимфоме.
Несмотря на то, что данный метод терапии выглядит многообещающим, у него есть ряд серьезных ограничений. Одно из них — необходимость применять собственные Т-клетки пациента. Поскольку терапевтические CAR-T-клетки производятся индивидуально для каждого больного, их создание получается длительным и дорогостоящим.
Альтернативой CAR-T-терапии могут стать NK-клетки, модифицированные химерным антигенным рецептором.
Применение NK-клеток не требует полной совместимости по человеческому лейкоцитарному антигену (HLA), что позволяет использовать аллогенные NK-клетки, заранее полученные от здоровых доноров и модифицированные CAR. Это ускоряет подготовку к терапии и снижает ее стоимость. Ученые из США трансдуцировали NK-клетки, полученные из донорской пуповинной крови, лентивирусным вектором, несущим CAR, специфичный к CD19, интерлейкин-15 для стимуляции экспансии и персистенции клеток in vivo, а также индуцибельную каспазу-9 на случай непредвиденного токсического эффекта (индукцией каспазы-9 можно запустить апоптоз). Такие CAR-NK-клетки продемонстрировали противоопухолевый эффект в доклинических испытаниях на мышиной модели, и сейчас проходят фазу I/IIa клинических испытаний (ClinicalTrials.gov, NCT03056339).
У одиннадцати пациентов с лимфомой либо хроническим лимфоцитарным лейкозом добились лимфодеплеции (устранения иммуносупрессивных факторов пациента, которые могут помешать действию введенных CAR-клеток) путем приема флударабина и циклофосфамида, после чего им однократно ввели CAR-NK-клетки в трех различных дозировках: 1×105, 1×106 либо 1×107 клеток на килограмм массы тела. При этом у девяти пациентов имелась частичная HLA-совместимость с донором NK-клеток, у двух совместимости не было.
Клинические испытания показали безопасность терапии CAR-NK-клетками. У пациентов не наблюдалось цитокинового шторма, признаков нейротоксичности либо реакции «трансплантат против хозяина». Уровни провоспалительных цитокинов, таких как интерлейкин-6 и TNFα, также оставались в пределах нормы. Эффективность CAR-NK-терапии составила 73%, то есть 8 из 11 испытуемых ответили на терапию, при этом у 7 пациентов была достигнута полная ремиссия, а у одного произошла ремиссия трансформации Рихтера, но сохранился хронический лимфоцитарный лейкоз. Ответ наблюдался в пределах 30 дней для всех трех дозировок CAR-NK, а присутствие CAR-NK-клеток в организме пациентов детектировалось в течение 1 года после введения.
Эффективность терапия CAR-NK-клетками требует дальнейших испытаний, однако предварительные результаты показывают, что пациенты с CD19-положительным раком отвечают на CAR-NK-терапию, и побочные эффекты относительно редки.

 Меню
Меню





 Все темы
Все темы




 0
0








