Клональная эволюция клеток хронического миелоидного лейкоза происходит быстрее, чем считалось
Считается, что развитию злокачественной опухоли предшествует накопление мутаций в течение десятилетий. Ученые из Великобритании и США установили, что при хроническом миелоидном лейкозе этот процесс происходит быстрее, занимая в некоторых случаях всего три-четыре года. Кроме того, драйверная перестройка BCR::ABL1 не приводит к бессимптомным изменениям гемопоэза, что свидетельствует о ее высокой патогенности. Также было продемонстрировано влияние скорости роста опухоли на эффективность терапии: чем она выше, тем хуже ответ.
Известно, что злокачественные опухоли возникают в результате длительного накопления мутаций, затрагивающих процессы клеточного роста и приспособления к условиям среды. Этот процесс занимает годы и даже десятилетия. Анализ мутационных профилей единичных клеток позволяет реконструировать филогенетические деревья и проследить эволюцию опухолевых клеток.
Ученые из Великобритании и США применили этот подход к изучению хронического миелоидного лейкоза (ХМЛ). Это заболевание занимает важное место в истории молекулярной онкологии. Описание характерных для него генетических перестроек (так называемой филадельфийской хромосомы, образованной транслокацией между хромосомами 9 и 22, — в 1960 году и возникшего при этой транслокации химерного онкогена BCR::ABL1 в 1973 году) положило начало онкогеномике и таргетной терапии опухолей.
Для исследования был отобран биоматериал (периферическая кровь и/или костный мозг) девяти пациентов с ХМЛ в возрасте от 22 лет до 81 года. Выделенные мононуклеарные клетки культивировали in vitro, чтобы получить колонии, происходящие от одной клетки и являющиеся источником клональной ДНК для полногеномного секвенирования.
Из 1013 полученных колоний 834 (то есть в среднем 93 колонии на пациента) прошли контроль качества и были использованы для анализа. В исследование были включены как BCR::ABL1-позитивные, так и BCR::ABL1-негативные клеточные колонии. Химерный ген BCR::ABL1 был обнаружен в клетках восьми из девяти пациентов, еще для одного пациента химерный ген удалось выявить только при секвенировании образца крови.
Ученые описали разнообразные генетические перестройки, сопровождающие формирование BCR::ABL1: делеции и дупликации различных участков ДНК, сложные транслокации, вовлекающие несколько хромосом, возникновение неканонических точек разрыва, сопровождающихся сдвигом рамки считывания (было установлено, что такие участки подвергаются сплайсингу, в результате чего образуется классический РНК-транскрипт). У двух пациентов были дополнительно выявлены мутации ASXL1, еще у одного — мутация RUNX1 (эти мутации влияют на прогноз при ХМЛ).
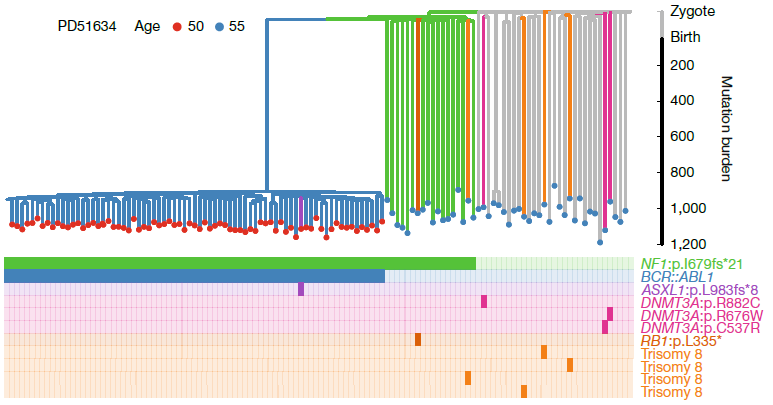
Используя результаты секвенирования, авторы построили филогенетические деревья для неопластических и нормальных гемопоэтических клеток. Это визуализировало стремительную клональную экспансию опухолевых клеток после появления драйверной мутации BCR::ABL1. С помощью математического моделирования авторы рассчитали время от возникновения BCR::ABL1-позитивного опухолевого клона до установления диагноза. Для двух самых молодых пациентов (22 года и 36 лет) оно было наиболее коротким — 3,2 года и 3,9 лет. При этом скорость роста опухолевого клона составила соответственно 99 000 000% и 26 800% в год (что соответствует удвоению опухолевой популяции каждые 18 и 45 дней). Для трех пациентов среднего возраста (45-55 лет) этот промежуток составил от 4,4 до 6,3 лет. Для самых старших пациентов (52 года, 61 год, 81 год) время от возникновения клона до диагностики ХМЛ было наибольшим (13,1 года, 14 лет и 10,3 года соответственно).
При этом пациенты с наиболее высокой скоростью роста опухолевого клона хуже других отвечали на терапию тирозинкиназными ингибиторами и не достигли так называемой молекулярной ремиссии (отсутствия химерной мРНК). Пациенты с самой низкой скоростью пролиферации неопластических клеток, наоборот, показали быстрый ответ на лечение.
 Nature (2025). DOI:
10.1038/s41586-025-08817-2 |
CC BY 4.0
Nature (2025). DOI:
10.1038/s41586-025-08817-2 |
CC BY 4.0
Известно, что нормальные гематопоэтические клетки накапливают около 18 мутаций в год. Исследователи продемонстрировали, что BCR::ABL1-положительные клетки накапливают на 90 мутаций больше. Чтобы выяснить, является ли это следствием дополнительных мутационных процессов или повышенной скорости клеточного деления, ученые проанализировали мутационные сигнатуры (паттерны нуклеотидных замен) в опухолевых и нормальных гемопоэтических клетках. Были выявлены одинаковые мутационные процессы: SBS1 (связанный с возрастом паттерн дезаминирования 5-метилцитозина), SBSblood (возраст-ассоциированный паттерн, характерный для гемопоэтических клеток) и SBS18 (паттерн, ассоциированный с окислительным стрессом). Не было выявлено мутаций, индуцированных терапией тирозинкиназными ингибиторами, и это опровергает гипотезу о том, что терапия сама по себе способствует геномной нестабильности. В опухолевых клетках отмечалась более высокая частота мутаций SBS1 и SBS18, что дополнительно подтверждает связь повышенной мутационной нагрузки при ХМЛ с высокой скоростью клеточного деления. При этом на этапе предлейкемического клона мутационный профиль не отличался от нормы: очевидно пролиферативная активность повышалась только после появления химерного гена BCR::ABL1.
Кроме того, теломеры BCR::ABL1-позитивных клеток укорачивались быстрее, чем в нормальных гемопоэтических клетках, даже у молодых пациентов. Это также свидетельствует о повышенной пролиферативной активности неопластических клеток, так как укорочение теломер является маркером клеточного деления.
Чтобы проверить, может ли транслокация BCR::ABL1 вызывать длительно существующий бессимптомный клональный гемопоэз, ученые проанализировали образцы 206 173 пациентов из американской когорты исследовательской программы All of Us. Химерный ген выявили у 39 пациентов (0.019%), что соотносится с частотой ХМЛ в США (0,02%). Кроме того, у большинства пациентов был установлен ХМЛ. Таким образом было показано, что мутация BCR::ABL1 не вызывает бессимптомный клональный гемопоэз.
Исследователи также показали, что прогрессия заболевания (переход от хронической фазы к фазам акселерации и бластного криза) ассоциирована с появлением дополнительных мутаций RUNX1p.Arg166*, ASXL1p.Tyr59fs, ASXL1.p.G646fs*12, BCORp.Leu532fs и изменением числа копий различных участков хромосом (увеличением числа копий 1q и 8, делецией 16q, инверсией 17q).
Новые сведения о скорости клональной пролиферации при ХМЛ могут способствовать персонализации терапии и поиску новых опций для пациентов с высокой скоростью деления опухолевых клеток и плохим ответом на терапию.
Т-клетки при хроническом лимфолейкозе теряют функциональность из-за недостатка холестерина
Источник
Kamizela, A.E., et al. Timing and trajectory of BCR::ABL1-driven chronic myeloid leukaemia // Nature (2025). DOI: 10.1038/s41586-025-08817-2


 Меню
Меню





 Все темы
Все темы




 0
0







