Лекарственно устойчивый штамм возбудителя туберкулеза из России найден в Албании и Греции
Штаммы недавно обнаруженного геноварианта Mycobacterium tuberculosis Beijing 1071-32 отличает множественная или широкая лекарственная устойчивость. Международный коллектив под руководством ученых из Санкт-Петербургского института Пастера разработал метод быстрого обнаружения этого генотипа. Изоляты Beijing 1071-32 были выявлены в Сибири (наиболее вероятный регион его происхождения) и Европейской России, в Средней Азии, Закавказье, а также в странах Балканского полуострова.
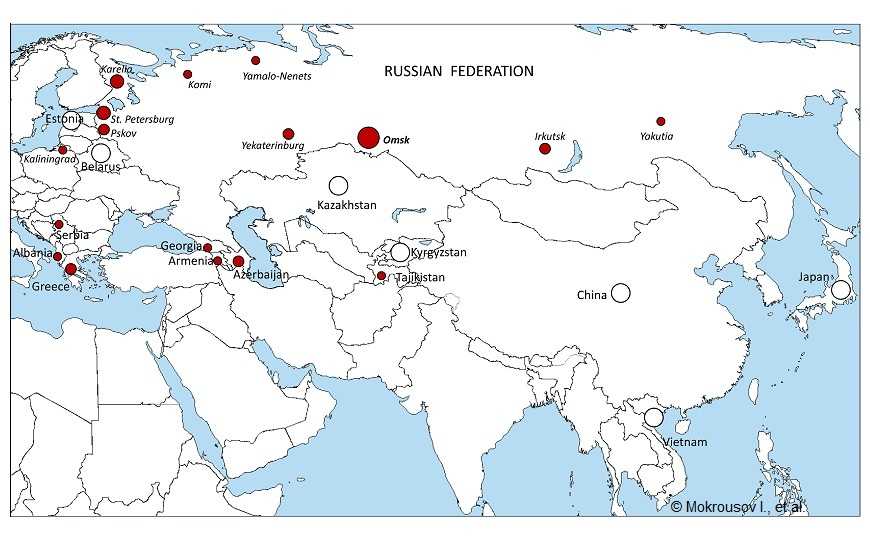
География распространения изученных штаммов кластера Beijing 1071-32. Размер круга примерно коррелирует с долей идентифицированных изолятов этого кластера (самые маленькие точки обозначают отдельные изоляты). Отсутствие в изученных локальных популяциях показано белым кружком
В журнале Scientific Reports опубликованы результаты нового исследования под руководством Игоря Мокроусова (Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера), в котором приняли участие ученые из различных регионов России и стран Европы, Азии и Южной Америки. Авторы разработали молекулярный метод для быстрого обнаружения штаммов эмерджентного геноварианта M. tuberculosis Beijing 1071-32, для которого характерна множественная лекарственная устойчивость (работа была выполнена при поддержке РНФ, грант 19-14-00013).
Ключевой негативный фактор лечения туберкулеза — недостаточно оперативная диагностика из-за медленного культивирования микобактерий туберкулеза. Надежная и быстрая диагностика не только возбудителя как такового (вид Mycobacterium tuberculosis), но и его известных эпидемических геновариантов необходима как для успешной реализации программ борьбы с туберкулезом, так и для лечения конкретных больных. M. tuberculosis изначально рассматривали как однородный, однако сейчас ясно, что этот вид генетически и функционально разнообразен, а его отдельные геноварианты имеют особую клиническую или эпидемиологическую значимость. Углубленный анализ таких генотипов позволяет обнаруживать их специфические маркеры, связанные с лекарственной устойчивостью, гипервирулентностью или трансмиссивностью.
Полногеномное секвенирование с использованием технологий следующего поколения (WGS/NGS) становится менее дорогим, и хотя технологии NGS не всегда доступны, есть мнение, что это можно исправить централизацией — организовать проведение такого рода анализов в небольшом количестве крупных центров. Однако широкое внедрение NGS для рутинной диагностики и эпиднадзора за туберкулезом в России нереально с учетом размеров страны и уровня заболеваемости (72 000 новых случаев в 2019 году). Необходимы быстрые, недорогие и высокопроизводительные методы обнаружения наиболее значимых эпидемических кластеров.
Ранее российские участники этой работы провели исследование в Омской области Западной Сибири и выявили неожиданное увеличение доли редких для России штаммов древней сублинии генотипа Beijing. Для некоторых также была показана высокая вирулентность в экспериментах на животных (подробнее на PCR.NEWS). Большинство изолятов принадлежали к кластеру Beijing 1071-32 и все имели множественную лекарственную устойчивость (МЛУ).
На основе филогенетического анализа полногеномных данных авторы статьи выявили три синонимичных SNP в генах Rv0144, Rv0373c и Rv0334, которые были специфичны для кластера Beijing 1071-32, и разработали метод их обнаружения с помощью ПЦР в реальном времени. Синонимичные SNP (не влияющие на аминокислотную последовательность белка) отражают нейтральную эволюцию, не подверженную влиянию отбора. Таким образом, их независимое возникновение в неродственных филогенетических группах практически невозможно, что повышает их надежность как строгого маркера именно генотипа Beijing 1071-32.
Анализ ДНК 2375 генетически разнообразных изолятов M. tuberculosis, собранных в период с 1996 по 2020 год в европейской и азиатской частях России, странах бывшего Советского Союза, Албании, Греции, Китае, Вьетнаме, Японии и Бразилии, подтвердил 100%-ную специфичность и чувствительность метода.
Все без исключения изоляты Beijing 1071-32 несли характерный набор из шести мутаций устойчивости (rpoB450, rpoC485, katG315, katG335, rpsL43 и embB497) к четырем ключевым антибиотикам первого ряда. Это комбинация включает наиболее частые и эффективные (с точки зрения микроба) мутации, а также редкие и компенсаторные, то есть компенсирующие снижение жизнеспособности микроба, вызванное мутациями устойчивости. Эпистатическое взаимодействие этих мутаций могло повлиять на распространение данного геноварианта.
Помимо ожидаемого присутствия Beijing 1071-32 в Сибири и европейской части России, эти штаммы были обнаружены в Средней Азии, Закавказье, а также, достаточно неожиданно, в балканских странах — Албании, Греции, Сербии. Неизвестно, отражает ли последнее уже локальную балканскую циркуляцию этого штамма или независимые события его заноса из стран бывшего СССР.
Анализ ДНК из Албании и Греции установил, что они содержали все 9 таргетных мутаций, то есть 3 нейтральных SNP и 6 мутаций устойчивости. Из Греции были получены три изолята Beijing 1071-32, один от иммигранта из Грузии, остальные два от местных пациентов. Так как генотип Beijing чрезвычайно редок в Албании, его изоляты, вероятно, попали в эту страну из соседней Греции, для которой характерно заметное присутствие репатриантов (и мультирезистентных штаммов) из бывшего СССР.
По мнению руководителя проекта Игоря Мокроусова, российское (предположительно сибирское) происхождение кластера Beijing 1071-32 — наиболее вероятный сценарий, поскольку этот кластер включает изоляты из отдаленных частей России, а некоторые изученные российские штаммы датируются 1996 годом.
— Обстоятельства его происхождения остаются неизвестными. По аналогии с известным эпидемическим российским штаммом Beijing B0/W148, который, вероятно, возник и распространился в сибирских тюрьмах в 1950-60-е годы, не исключено, что штамм Beijing 1071-32 мог изначально возникнуть и сформироваться в условиях пенитенциарной системы, — отмечает Игорь Мокроусов.
Филогеномный анализ позволил датировать происхождение Beijing 1071-32 серединой 1970-х годов, когда рифампицин был впервые включен в противотуберкулезную химиотерапию. Другие антибиотики, к которым устойчив этот штамм, были включены в химиотерапию туберкулеза еще раньше. В этом сценарии обнаруживаются параллели с эволюцией штаммов в Португалии и Южной Африке, в которых эндемичные резистентные варианты генетического семейства LAM (Latin American Mediterranean ) стали мультирезистентными в 1970-е годы.
Примечателен тот факт, что все географически удаленные изоляты этого кластера имеют один и тот же набор из шести мутаций устойчивости к четырем антибиотикам. Не были обнаружены промежуточные штаммы Beijing 1071-32 с некоторыми, но не всеми мутациями из этого набора. Вероятно, добавление новых мутаций делало штамм более приспособленным по сравнению с промежуточными вариантами с неполным профилем мутаций, которые, таким образом, исчезли из популяции.


 Меню
Меню





 Все темы
Все темы




 0
0








