Липидные наночастицы усовершенствовали с помощью химической эволюции
Ученые из Китая и США задались целью оптимизировать липидные наночастицы, применяемые для доставки терапевтических генов и мРНК-вакцин. Они воспользовались методом направленной химической эволюции, чтобы сконструировать один из четырех ключевых компонентов наночастиц — ионизируемые липиды, отвечающие за высвобождение груза в клетке и биосовместимость. Новая структура повысила эффективность доставки по сравнению с коммерческими вариантами (например, входящими в состав мРНК-вакцины от SARS-CoV-2, производимой компанией Moderna).
Липидные наночастицы все чаще предлагают применять для доставки мРНК-вакцин и в качестве невирусного вектора для доставки терапевтических конструктов (например, системы редактирования CRISPR-Cas9). Однако работы по повышению специфичности доставки, биосовместимости и простоты синтеза их компонентов продолжаются. Исследователи из США и Китая опубликовали статью в Nature Biomedical Engineering, в которой описали применение направленной химической эволюции для оптимизации липидных наночастиц.
В состав липидных наночастиц входят четыре ключевых компонента: ионизируемые липиды, фосфолипиды, холестерин и липиды, конъюгированные с полиэтиленгликолем (ПЭГ). Первый из них отвечает за надежность доставки молекул, загруженных в наночастицы, и за биосовместимость. В кровотоке наночастицы с ионизируемым липидом заряжены нейтрально, а при попадании в клетку они приобретают положительный заряд под действием кислой среды лизосом. Эта смена заряда и обеспечивает выход целевой молекулы — например, мРНК.
Существующие методы получения ионизируемых липидов зачастую либо низкопроизводительны, либо не позволяют синтезировать молекулы с высокой специфичностью нацеливания и биосовместимости одновременно. Исследователи предложили усовершенствовать разработку этих соединений с помощью комбинаторной А3-химии — трехкомпонентной реакции альдегида с алкином и амином, приводящей к образованию пропаргиламина и его производных. Пропаргиламин включили в состав ионизируемых липидов, которые в норме состоят из аминогруппы и двух или более алкильных хвостов, соединенных линкерами. Их обозначили как А3-липиды.
Такая реакция никогда не применялась для синтеза ионизируемых липидов, поэтому для начала исследователи создали пробную библиотеку из 180 А3-липидов, комбинируя 30 коммерчески доступных аминов, формальдегид и шесть различных алкинов. Ароматические алкины давали более высокий выход реакции, поэтому для дальнейшей работы авторы выбрали именно их. Оставшиеся 90 оставшихся вариантов А3-липидов испытали in vitro для доставки мРНК в клетки гепатоцеллюлярной карциномы линии HepG2 (в качестве репортера в мРНК закодировали люциферазу).
Соединение, из которого удалось изготовить наиболее эффективно доставляющие наночастицы, выбрали затем для дальнейшей оптимизации — в его структуру внесли расщепляемый эфирный линкер, а алкильные хвосты заменили на разветвленные. Такая модификация улучшила трансфекцию in vitro, но полученные in vivo результаты слабо с этим коррелировали. Исходя из конечной задачи — применения липидных наночастиц для доставки в организме — авторы решили в дальнейшем оценивать только их эффективность in vivo. Такие опыты проводили на мышах, внутривенно вводя им вектор, а затем оценивая экспрессию люциферазы при введении ее субстрата — люциферина — внутрибрюшинно.
Дополнительно повысить эффективность доставки репортерной люциферазы в клетки ученым помогла асимметричная структура липидов. Их решили протестировать, исходя из уже имеющихся литературных данных о влиянии такой структуры на плотность упаковки липидов в бислое. Асимметричные молекулы, основанные на третичных аминах, оказались даже немного надежнее, чем нынешний стандарт MC3. Их также сделали биоразлагаемыми за счет включения эфирной связи в молекулу.
Последнюю из полученных библиотек липидов авторы протестировали на доставку люциферазы in vivo. Восемь асимметричных А3-липидов обошли по эффективности трансфекции липид MC3. При этом четыре из них обеспечивали более чем пятикратное повышение экспрессии люциферазы (наиболее эффективный — в восемь раз).
Определив оптимальную структуру линкера и хвостов, ученые вернулись к усовершенствованию ионизируемой группы. Скрининг выявил еще 11 вариантов аминов, обеспечивающих приемлемую эффективность трансфекции.
Авторы заключили, что наиболее оптимальную структуру ионизируемого липида составят длинные, разветвленные и асимметричные хвосты, включение в реакцию амина с дикарбоновой кислотой и определенное положение расщепляемой эфирной связи, которое позволит контролировать биодеградацию соединения. Наилучшим вариантом также оказалось наличие ровно двух ионизируемых атомов азота.
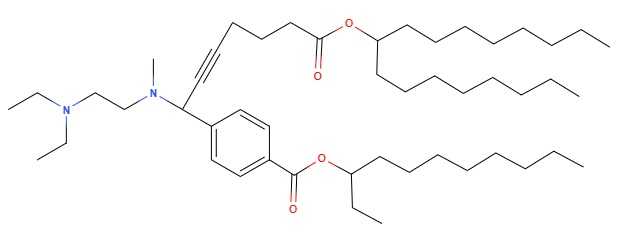 Структура ионизируемого липида 31hP — наиболее оптимального среди полученных авторами компонента наночастиц.
Структура ионизируемого липида 31hP — наиболее оптимального среди полученных авторами компонента наночастиц.Credit:
Изображение получено с помощью MolView.
Липид, показавший наилучшую эффективность доставки полученных из него наночастиц, охарактеризовали с точки зрения физических свойств, стабильности и биосовместимости. При pH 7,4 он продемонстрировал высокую гемосовместимость и был стабилен в коллоидном растворе (неделя хранения при 4 °C лишь незначительно изменила его свойства). Анализ механизмов трансфекции показал, что поглощение липидных наночастиц клетками обеспечивается в основном через макропиноцитоз и эндоцитоз, опосредованный липидным рафтом.
Дальнейшие опыты на мышах подтвердили применимость усовершенствованных наночастиц для доставки CRISPR-Cas9 или мРНК-вакцин. С помощью CRISPR-Cas9 исследователи на 30% снизили в крови модельных мышей уровень мутантного транстиретина, который ассоциирован с амилоидозом. Органом-мишенью для редактирования выбрали печень. Доставку мРНК-вакцин проверяли на вакцине от SARS-CoV-2, и оказалось, что разработанные липидные наночастицы приводили к меньшей внецелевой экспрессии мРНК, чем коммерческий вариант, который использует в своей вакцине Moderna. Выраженной гепатотоксичности при этом выявлено не было.
Таким образом, исследователи продемонстрировали рациональный дизайн ионизируемого липида. Каждую последующую библиотеку с модификациями того или иного участка структуры получали «мутацией» наилучшего А3-липида, отобранного на предыдущем этапе, — такой подход и носит название направленной химической эволюции. Все это позволило выявить связь между структурой молекулы и ее активностью, чтобы исходя из этого повысить эффективность доставки наночастиц.
Новые липидные наночастицы избирательно доставляют мРНК в мышцы
Источник
Han, X., et al. Optimization of the activity and biodegradability of ionizable lipids for mRNA delivery via directed chemical evolution. // Nat. Biomed. Eng 8, 1412–1424 (2024). DOI: 10.1038/s41551-024-01267-7


 Меню
Меню





 Все темы
Все темы




 0
0








