Макрофаги удаляют мертвые ткани перед регенерацией печени
Ученые из США и Германии описали роль макрофагов в регенерации печени. Оказалось, что макрофаги периферической крови концентрируются вокруг места некроза и стимулируют экспрессию SOX9 в гепатоцитах, а также активацию клеток Ито. Такой механизм запускает формирование барьера вокруг зоны некроза, а также индуцирует начало пролиферации в здоровых тканях печени.
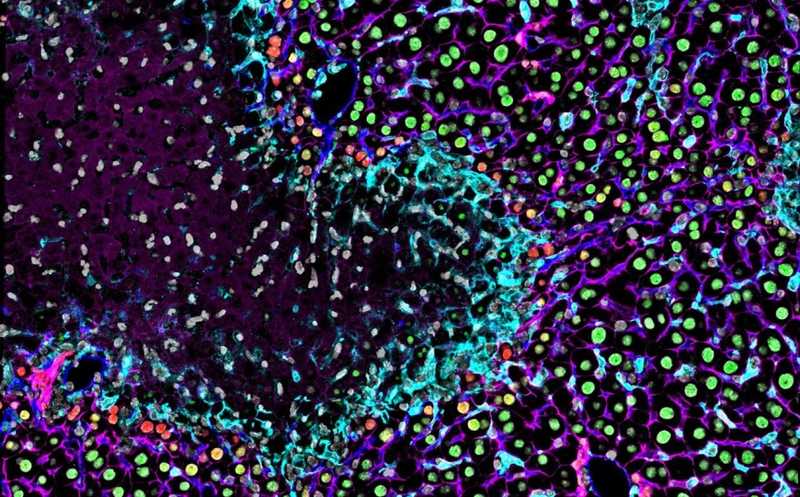
Иммунофлуоресцентное окрашивание тканей печени через 48 часов после повреждения, вызванного конканавалином А: происходящие из моноцитов макрофаги (голубой цвет) инкапсулируют некротические участки и способствуют экспрессии SOX9 (красный) в гепатоцитах (окрашены зеленым).
Credit:
By Dr. Dechun Feng |
пресс-релиз
Печень обладает высокими способностями к регенерации, в том числе при повреждениях, ассоциированных с некрозом тканей. Если сами процессы регенерации описаны достаточно подробно, то механизмы удаления мертвых тканей пока изучены относительно слабо. Исследование, опубликованное в The Journal of Clinical Investigation, показало, что ключевую роль в удалении некротической ткани играют макрофаги периферической крови.
Авторы использовали конканавалин A (ConA) для индукции травмы печени у мышей. В течение 24 часов после инъекции ConA в печени развивались крупные некротические бляшки, которые затем уменьшались в размерах к 96 часу после инъекции и полностью исчезали в течение 7 дней.
В процессе развития и регенерации повреждений исследователи наблюдали агрегацию непаренхиматозных и иммунных клеток вокруг некротической бляшки. Большинство из них были представлены CD45+ иммунными клетками, формирующими «кольцо» вокруг места травмы. Дальнейшие иммунофлуоресцентные окрашивания выявили присутствие в месте повреждения макрофагов, происходящих из моноцитов (MoMF), уже на 24 час после инъекции. Большая их часть происходила из костного мозга. На более поздних этапах к очагу некроза также стягивались клетки Ито (HSC) и нейтрофилы. Интересно, что миграции клеток Купфера (резидентных макрофагов печени) к месту травмы не наблюдалось. Опыты с мышами, у которых отсутствуют различные рецепторы макрофагов, показали, что рекрутирование макрофагов идет через рецептор CCR2.
С помощью иммуноокрашивания ученые установили, что вокруг места повреждения скапливаются SOX9+ клетки. Этот маркер экспрессируется в прогениторных клетках, но не во взрослых гепатоцитах. Дополнительный анализ показал, что SOX9+ клетки вокруг места некроза больше схожи с гепатоцитами, поэтому авторы обозначили их как SOX9+ гепатоциты. Исследователи выяснили также, что у мышей с искусственно сниженной популяцией MoMF и у Ccr2-/- мышей число SOX9+ гепатоцитов вокруг места некроза значительно снижалось (на 90% в случае Ccr2-/- мышей). Анализ сигнальных путей указал на JAG1/NOTCH путь как основной, по которому MoMF влияют на экспрессию SOX9.
Примечательно, что дальнейшие анализы показали отсутствие пролиферативной активности у SOX9+ гепатоцитов, в то время как гепатоциты в неповрежденных частях печени активно пролиферировали. При этом внутри некротических тканей пролиферативной активности не наблюдалось — это указывает на то, что SOX9+ гепатоциты участвуют в формировании барьера вокруг очага некроза. У Sox9-/- мышей площадь некротических бляшек была больше, а пролиферация гепатоцитов в здоровых тканях происходила медленнее.
Активированные клетки Ито (aHSC) наряду с MoMF вносили основной вклад в формирование кольцевой структуры вокруг места некроза. Так, aHSC вокруг места травмы экспрессировали маркеры сокращения гладкой мускулатуры. Искусственное снижение популяции MoMF или делеция Ccr2, приводили к почти полной потере активированных HSC и замедляло процессы регенерации.
Анализ экспрессии генов выявил два основных кластера MoMF, концентрирующихся вокруг места травмы. Первый кластер активно экспрессировал C1q — ген, ассоциированный с удалением мертвых клеток. Второй кластер характеризовался экспрессией Pdgfb — фактора роста и активатора HSC. Входившие в него макрофаги стимулировали aHSC-опосредованное сокращение гладкой мускулатуры, которая стягивала очаг некроза и способствовала его удалению. Нокаут Pdgfb значительно снижал число активированных HSC в зоне некроза.
Дальнейшие опыты показали, что делеция C1q замедляла регенерацию и приводила к большей площади некроза. Авторы также установили, что индукция формирования кластера C1q+-макрофагов, удаляющих мертвые клетки, вокруг очага некроза ассоциирована с гипоксией в некротических тканях. В in vitro опытах воздействия гипоксии на макрофаги было достаточно, чтобы повысить экспрессию C1q+ и сформировать соответствующий кластер.
Полученные данные были проверены на ряде других моделей повреждения печени.
Работа продемонстрировала, что макрофаги периферической крови играют ключевую роль в процессах удаления мертвых тканей при повреждении печени за счет координации действий SOX9+ гепатоцитов и клеток Ито.
Взаимодействие холангиоцитов и мезенхимальных клеток печени регулирует ее регенерацию
Источники
Feng D, et al. Monocyte-derived macrophages orchestrate multiple cell-type interactions to repair necrotic liver lesions in disease models // The Journal of Clinical Investigation (2023). DOI: 10.1172/jci166954
Rodrigues RM, Boeckmans J, Vanhaecke T. Macrophages clear out necrotic liver lesions: a new magic trick revealed // eGastroenterology (2023). DOI: 10.1136/egastro-2023-100024


 Меню
Меню





 Все темы
Все темы




 0
0








