Мандимицин — новое природное соединение, эффективное против резистентных грибков
Традиционный скрининг активности для поиска антибиотиков часто приводит к повторному обнаружению известных соединений, особенно в случае противогрибковых препаратов. При этом лекарственно-устойчивые грибковые патогены представляют серьезную угрозу здоровью человека. Авторы публикации в Nature прибегли к филогенетически-ориентированному подходу и обнаружили уникальный природный полиеновый макролид — мандимицин. Он отличался механизмом действия от других полиеновых макролидов и обладал мощной фунгицидной активностью против широкого спектра мультирезистентных грибковых патогенов как in vitro, так и in vivo.
Грибковые патогены с множественной лекарственной устойчивостью — серьезная угроза для здоровья человека, особенно на фоне растущего числа людей с ослабленным иммунитетом и чрезмерным использованием противогрибковых препаратов. Для борьбы с распространением таких инфекций необходимо разрабатывать новые препараты с уникальными механизмами действия. Авторы статьи в Nature применили филогенетический подход, чтобы найти природные антимикотики среди полиеновых макролидов — семейства соединений с разнообразными структурами, противогрибковой активностью широкого спектра и низким риском развития резистентности.
Ученые провели филогенетический скрининг, ориентируясь на гликозилтрансферазы, отвечающие за перенос микозамина — аминосахара, содержащегося в некоторых полиеновых антимикотиках, — на полиеновое макролидное кольцо. С помощью скрытой марковской модели они систематически проанализировали базу данных вторичных микробных метаболитов (MiSM). Анализ выявил 280 кандидатных кластеров генов биосинтеза, предположительно участвующих в выработке полиеновых макролидов. Построенное по ним филогенетическое древо включало несколько клад, из которых авторов заинтересовала одна, не связанная ни с одним из известных полиеновых макролидов.
Для детального изучения этой клады исследователи выбрали репрезентативный кластер генов биосинтеза, обнаруженный у Streptomyces netropsis штамма DSM 40259 и обозначенный как mand BGC.
Генное аннотирование mand BGC выявило шесть генов (mandD, mandE, mandF, mandL, mandM и mandN), кодирующих поликетидные синтазы. Суммарно они содержат 19 модулей и предположительно обеспечивают синтез 38-членного макролактонового кольца. Кроме того, в кластере генов были обнаружены два гена гликозилтрансфераз (mandK и mandQ), предназначенных для переноса дезоксисахаров.
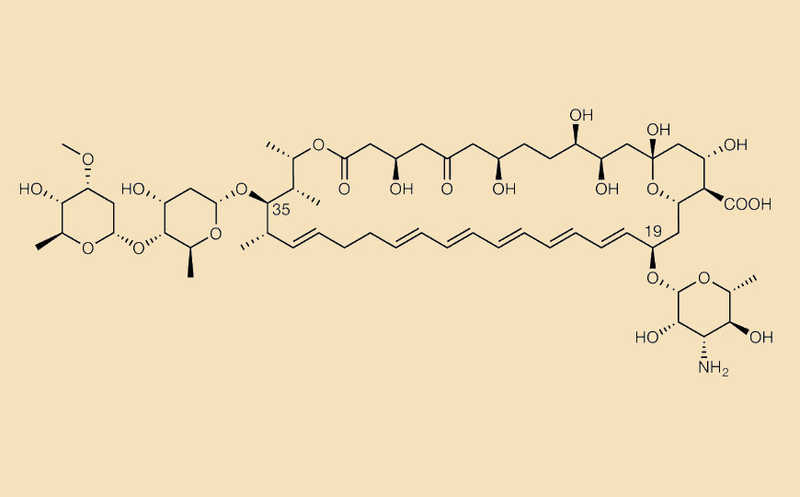
Затем авторы культивировали S. netropsis DSM 40259 на различных средах, чтобы выделить вторичные метаболиты, кодируемые этим кластером генов. Экстракты культур анализировали высокоэффективной жидкостной хроматографией, которая подтвердила наличие характерного пика поглощения в УФ-диапазоне. Дальнейшее структурное исследование включало масс-спектрометрию с ионизацией электрораспылением высокого разрешения (HR-ESI-MS), двумерную спектроскопию ядерного магнитного резонанса (ЯМР) и компьютерное моделирование. Все это позволило однозначно определить структуру мандимицина — уникального 38-членного гликозилированного полиенового макролида. По структуре он значительно отличался от всех известных аналогов (например, амфотерицина В, нистатина и кандицидина).
Противогрибковую активность исследователи проверяли на ряде патогенных грибков, внесенных Всемирной организацией здравоохранения в список приоритетных патогенов. Все они были устойчивы к двум-четырем противогрибковым препаратам, включая каспофунгин, флуконазол, тербинафин и 5-фторцитозин. Мандимицин проявлял мощную активность широкого спектра действия против всех протестированных патогенов с МЛУ, а его минимальные ингибирующие концентрации варьировали от 0,125 до 2 мкг/мл. В частности он был эффективен против лекарственно-устойчивых видов Candida — основного возбудителя инвазивных кандидозов у пациентов с ослабленным иммунитетом. Смертность при таких инфекциях превышает 50%. А вот антибактериальной активности соединение не имело — как против грамположительных, так и против грамотрицательных патогенов.
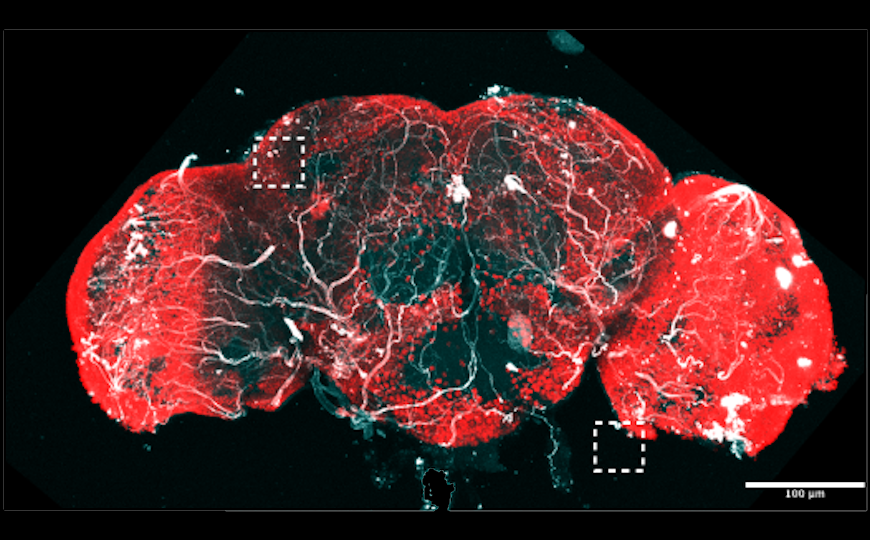
Для изучения механизма действия ученые выбрали хорошо изученный штамм Candida albicans BNCC 186382 в качестве модельного. Выяснилось, что мандимицин нарушал целостность клеточных мембран грибков — мембрана C. albicans начинала разрушаться через 2 часа после обработки соединением и полностью распадалась через 8 часов.
Многие полиеновые макролидные антибиотики, такие как амфотерицин В, удаляют из мембраны своих мишеней эргостерол и тем самым повреждают эти мембраны. Однако противогрибковая активность мандимицина совершенно не была связана с эргостеролом. Дальнейший анализ структуры соединения и внесение мутаций (в том числе делетирующих) в ферменты его синтеза позволили ученым определить, что мандимицин — это противогрибковая молекула, которая целенаправленно воздействует на фосфолипиды, в частности на фосфатидилинозитол.
Повреждение почек и гемолиз — распространенные и серьезные побочные эффекты, полиеновых противогрибковых препаратов, поэтому проверка токсичности стала следующим этапом работы. В анализе цитотоксичности in vitro мандимицин показал низкую токсичность в отношении человеческих клеточных линий — эпителиальных клеток проксимальных канальцев почек (HK-2), первичных эпителиальных клеток проксимальных канальцев почек (RPTEC) и ряда других. Полумаксимальная ингибирующая концентрация лежала в диапазоне от 48,28 до 88,67 мкМ — в 7-22 раза выше, чем у амфотерицина B.
Далее исследователи оценили нефротоксичность мандимицина in vivo, вводя его мышам подкожно или внутривенно. Биомаркеры повреждения почек (KIM-1, LCN-2, TIMP-1 и SPP-1) оставались практически неизменными как на транскрипционном, так и на белковом уровнях даже при максимальной дозе. Гистопатология срезов почек выявила небольшие изменения после однократного внутривенного введения 30 мг/кг мандимицина. Фармакокинетические параметры мандимицина также оказались благоприятными, с периодом полувыведения 3,84 ч.
Чтобы изучить терапевтическую эффективность мандимицина в естественных условиях, авторы смоделировали на мышах системную инфекцию кандидой. Инфицированных мышей лечили разными дозами мандимицина — 1, 5, 10 и 20 мг/кг — вводя их подкожно в течение четырех дней. Наблюдалось дозозависимое увеличение выживаемости, причем с дозой 10 мг/кг она достигала 100%. Грибковая нагрузка в основных органах также снижалась дозозависимо. В почках и легких он уменьшал грибковую нагрузку более чем на 3 логарифмические единицы на грамм (то есть более чем в тысячу раз). Учитывая, что десятикратное снижение грибковой нагрузки считается эффективным у человека, авторы приходят к выводу о крайне высокой перспективности обнаруженного ими соединения для лечения системных инфекций. В терапии кожных грибковых поражений и инфекций мягких тканей (их тоже проверяли на мышиной модели) препарат также показал себя весьма эффективным, в том числе в сравнении с уже известным амфотерицином В.
Авторы публикации заключают: уникальная структура и механизм действия обнаруженного ими соединения открывают перспективу для разработки противогрибковых препаратов. Они подчеркивают важность дальнейших исследований, которые позволят оценить эффективность и токсичность мандимицина в клинических условиях, а также целесообразность использования фосфолипидов в качестве мишеней при разработке противогрибковых средств.
Фунгицид на основе амфотерицина B оказался нетоксичным для человека
Источник
Deng, Q., et al. A polyene macrolide targeting phospholipids in the fungal cell membrane. // Nature (2025). DOI: 10.1038/s41586-025-08678-9


 Меню
Меню





 Все темы
Все темы



 0
0