Патогенные грибки манипулируют врожденным иммунитетом насекомых-хозяев, защищаясь от него и вызывая нейродегенерацию
Грибковые инфекции способны приводить к нейродегенерации. На мушках-дрозофилах хорошо изучено, что заражение патогенным грибком активирует врожденный иммунитет через сигнальный путь рецепторов Toll, который запускает выработку антимикробных пептидов. В мозге сигнал от этих рецепторов может передаваться неканоническим путем — при участии адаптерных молекул Wek и Sarm — и, в зависимости от обстоятельств, способствовать выживанию или гибели клеток. Ученые из Великобритании и Испании обнаружили, что патогенные грибки используют этот альтернативный путь для уклонения от иммунной защиты и усиления разрушающего воздействия на нейроны мозга.
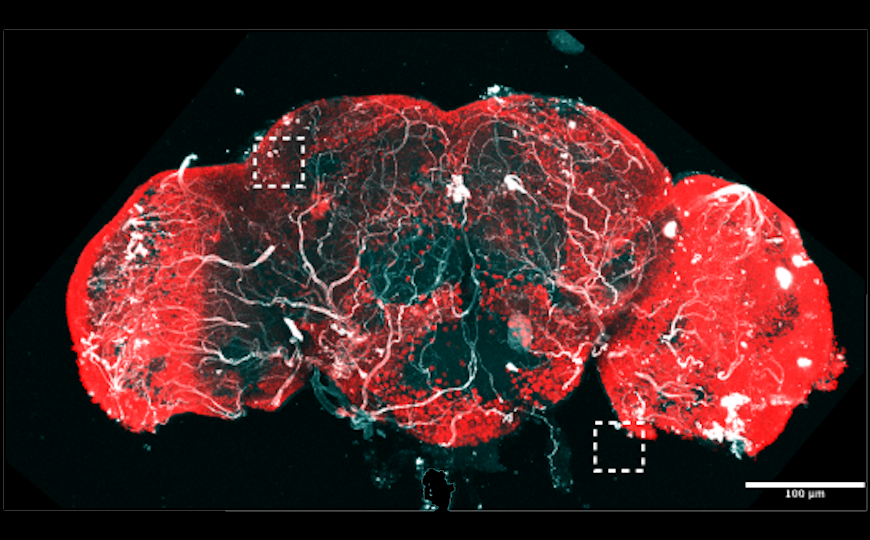
Клетки грибка контактируют с нейронами в мозге дрозофилы.
Credit:
PLoS Biology, 2025. DOI:
10.1371/journal.pbio.3003020 |
CC BY
Патогенные грибки способны изменять поведение насекомых-хозяев и вызывать у них нейродегенерацию, приводящую в итоге к гибели зараженного организма и распространению патогена. Молекулярный механизм, лежащий в основе врожденного иммунного ответа на грибковые инфекции, очень консервативен и хорошо изучен у плодовой мушки Drosophila melanogaster. Грибковая инфекция активирует рецепторы Toll — благодаря их открытию были обнаружены гомологичные им толл-подобные рецепторы (TLR) млекопитающих. Далее сигнал передается при участии адаптерной молекулы MyD88, вызывающей перемещение в ядро транскрипционного фактора Dif/NF-κB, который, в свою очередь, активирует экспрессию антимикробных (в том числе антигрибковых) пептидов.
До сих пор неизвестно, как грибки преодолевают защитные барьеры мозга. В нервной системе передача сигналов от рецепторов Toll может происходить через альтернативные адаптерные молекулы Weckle (Wek) и Sarm, причем сигнал может способствовать как выживанию, так и гибели клеток. Ученые из Великобритании и Испании задались вопросом, участвует ли альтернативный сигнальный путь Toll-Wek-Sarm в развитии нейродегенерации при грибковых инфекциях. Результаты опубликованы в журнале PLoS Biology.
Дрозофил заражали культурой патогенного грибка Beauveria bassiana — известного активатора Toll-рецепторов. Неинфицированные контрольные мухи дикого типа жили до 70 дней, в то время как зараженные — не более 20, при этом более половины мух погибло уже к седьмому дню. В течение первых трех дней после инфицирования у мух не наблюдалось никаких изменений в поведении, однако затем у них нарушалась способность ползать — по-видимому, нейродегенерация, вызванная грибковой инфекцией, затрагивала двигательную активность. Опыты с флуоресцентной меткой показали, что B. bassiana проникает через гематоэнцефалический барьер (ГЭБ).
Даже поглощенные с пищей споры патогенного гриба оказались способны проникать в мозг и вызывать инфекцию. Экспрессия Toll-1 и Sarm — молекул, которые должны обеспечивать защитную иммунную реакцию в ответ на грибок, — была обнаружена в сенсорных нейронах хоботка дрозофил. Оказалось, что активация несущих Sarm нейронов способствует реакции расширения хоботка, необходимой для питания. Это значит, что нейроны хоботка, экспрессирующие Sarm, вместо обеспечения противогрибковой защиты способствуют поглощению B. bassiana и усугубляют инфекцию.
Заражение B. bassiana активировало Toll-1 рецептор и приводило к усилению экспрессии адаптерных молекул Wek и Sarm в мозге дрозофил. После семи дней грибковой инфекции погибали глиальные клетки, из которых состоит ГЭБ, — это могло облегчать проникновение грибка в мозг. Также гибли Sarm-положительные и дофаминовые нейроны. Нокдаун Toll-1, wek или sarm с помощью РНК-интерференции предотвращал потерю глиальных клеток и дофаминовых нейронов при инфицировании B. bassiana, подтверждая, что грибок использует этот сигнальный путь врожденного иммунитета в своих целях. Искусственно повышенная экспрессия wek или sarm сама по себе приводила к гибели нейронов в отсутствие инфекции.
Авторы заключают, что передача сигналов от Toll-1 рецептора через адаптерные молекулы MyD88 и Dif/NFκB способствует выработке антимикробных пептидов и уничтожению грибков, в то время как альтернативная передача через Wek и Sarm, напротив, подавляет MyD88-зависимый врожденный иммунитет и приводит к гибели нейронов при грибковой инфекции.
Аналогичная активация Sarm после стимуляции TLR при грибковых инфекциях может лежать в основе психических и нейродегенеративных заболеваний у людей. Уже известно, что споры патогенных грибов могут обнаруживаться в мозге пациентов с болезнью Паркинсона и Альцгеймера.
Патогенные грибы предпочли сотрудничество конкурентной борьбе
Источник
Singh DND, et al. Toll-1-dependent immune evasion induced by fungal infection leads to cell loss in the Drosophila brain. / PLoS Bio, 2025, 23(2): e3003020. DOI: 10.1371/journal.pbio.3003020


 Меню
Меню





 Все темы
Все темы




 0
0