Механизм развития диабетической кардиомиопатии плода изучили на органоидах сердца
Прегестационный диабет матери в 12 раз увеличивает риск развития врожденных пороков сердца у плода. Ученые из США создали органоид сердца и исследовали механизмы развития вызванной сахарным диабетом врожденной кардиомиопатии. Они также предложили возможные способы ее профилактики и лечения на ранних сроках беременности с помощью омега-3 полиненасыщенных жирных кислот и сапроптерина — препарата, назначаемого при фенилкетонурии.
Credit:
Aleksandra Kostina, PhD | Пресс-релиз
Среди врожденных аномалий развития человека наиболее часто встречаются врожденные пороки сердца (ВПС). Одним из факторов риска появления этой патологии является нарушение углеводного обмена матери — прегестационный сахарный диабет (ПСД). Сердце эмбриона формируются рано — с четвертой по девятую недели гестации. В это время ткани развивающегося органа наиболее уязвимы для патогенного воздействия гипергликемии.
ПСД развивается до беременности или в течение первого триместра гестации. У новорожденных детей таких женщин вероятность наличия ВПС в 12 раз выше, чем в общей популяции. При этом ПСД сложно контролировать, так как эмбрион очень чувствителен к колебаниям уровня глюкозы в крови. Для изучения процесса формирования сердца в условиях ПСД авторы статьи в Stem Cell Reports создали модель сердца — органоид — и наблюдали за изменениями, происходящими в нем под действием высокого уровня глюкозы.
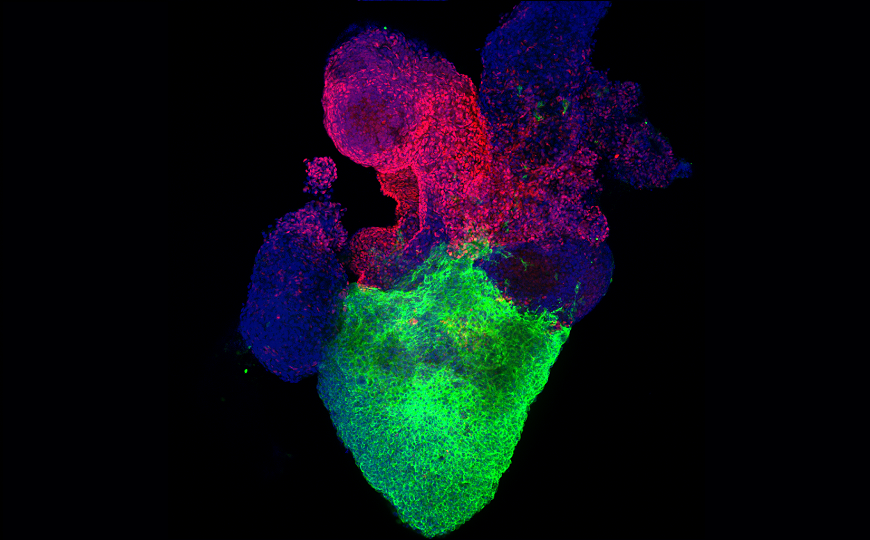
Целью исследователей было создание модели, способной показать приближенную к реальности картину ПСД-индуцированных процессов в сердце эмбриона. Из стволовых клеток они вырастили органоиды, достаточно точно повторяющие этапы эмбриогенеза сердца, происходящие в первый триместр. Ученые поместили две группы органоидов в нормогликемическую и гипергликемическую среды и в течение 14–15 дней наблюдали за дифференцировкой клеток. Так, с помощью иммунофлуоресцентного метода они обнаружили значительное увеличение (на 27%) размера кардиомиоцитов в условиях, имитирующих ПСД, по сравнению с клетками в нормогликемической среде.
Затем авторы исследовали экспрессию транскрипционных факторов, ключевых в эмбриогенезе сердца (HAND1, HAND2, GATA4 и др.). Клетки в гипергликемической среде отличались аномальной экспрессией этих факторов. Экспрессия генов транспортеров глюкозы также была нарушена: уровень SLC2A1, в норме особенно активного в эмбриональном сердце, оказался снижен в ранние дни дифференцировки. Это может быть признаком нарушения гликолиза и транспорта глюкозы в ПСД-кардиомиоцитах.
Степень васкуляризации органоида, оцененная с помощью иммунофлуоресцентной окраски белка PECAM1 (маркера эндотелиальных клеток), оказалась менее выраженной и организованной в гипергликемической среде по сравнению с контролем. Сравнивались и функциональные показатели (по изменению концентрации кальция) — частота сердечных сокращений в диабетическом органоиде была снижена, наблюдались частые эпизоды аритмии.
Для изучения воздействия ПСД на отдельные виды клеток сердца авторы провели РНК-секвенирование единичных клеток, в результате которого выделили семь отдельных популяций. Из них обращало на себя внимание снижение числа кардиомиоцитов и увеличение числа клеток эпикарда в органоиде, инкубированном в условиях ПСД.
Далее авторы проанализировали дифференциальную экспрессию генов — наибольшие отклонения наблюдались в экспрессии генов кардиомиоцитов, что указывает на высокую чувствительность этих клеток эмбриона к гипергликемии.
Они изучили взаимодействия между клетками разных типов. Оказалось, что эпикардиальные клетки значительно меньше «общались» с другими клетками в диабетическом органоиде, чем в нормальном. Авторы подозревают, что нарушение функции клеток эпикарда может играть критическую роль в эмбриогенезе сердца в условиях ПСД.
Ученые также исследовали такое явление, как «стресс» эндоплазматического ретикулума (ЭПР) в кардиомиоцитах как результат гиперпродукции АФК. Основной показатель ЭПР-стресса — инозитол-зависимый фермент 1 (IRE1), его активация путем фосфорилирования в мембране ЭПР при стрессе ведет к разрушению мРНК, локализованных в ЭПР. Уровень фосфорилированной формы IRE1 был повышен в клетках при ПСД, из чего следует вывод, что при диабете ЭПР-стресс более выражен, чем в норме.
Кроме того, с помощью жидкостной хроматографии с масс-спектрометрией были выявлены нарушения в синтезе омега-3 полиненасыщенных жирных кислот (ПНЖК), таких как эйкозапентаеновая и докозагексаеновая кислоты, которые незаменимы в процессе развития сердца.
Тогда авторы попытались найти связь между ЭПР-стрессом и дисбалансом ПНЖК, так как гладкий ЭПР играет большую роль в синтезе жирных кислот. При оценке экспрессии генов десяти ферментов, участвующих в синтезе липидов и функционирующих в ЭПР, были обнаружены значительные нарушения многих из них, в том числе снижение экспрессии FADS2. Этот ген кодирует дельта-6-десатуразу — ключевой фермент синтеза ПНЖК в ЭПР. Участие IRE1 в разрушении мРНК этого фермента подтвердили путем нокаута гена IRE1 в модифицированной линии стволовых клеток, а также воздействием на него селективным ингибитором, в результате чего уровень фермента был восстановлен.
Наконец, опираясь на полученные данные, исследователи протестировали несколько вариантов терапии ПСД-индуцированных изменений в сердце эмбриона. Они воздействовали на диабетические органоиды тауроурсодезоксихолевой кислотой (TUDCA), комбинацией омега-3 ПНЖК и сапроптерином (BH4). Всем трем веществам удалось значительно снизить степень гипертрофии кардиомиоцитов и восстановить экспрессию FADS2. Омега-3 ПНЖК и BH4 также снизили показатели ЭПР-стресса. Эти вещества можно потенциально использовать в виде пищевых добавок для женщин в первом триместре беременности.
Результаты исследования могут стать отправной точкой в создании новых профилактических и терапевтических стратегий для снижения распространенности ВПС. Авторы статьи подчеркивают особую ценность органоида сердца в качестве модели для изучения человеческих болезней и разработки лекарств.
Источник:
Kostina A., et. al. ER stress and lipid imbalance drive diabetic embryonic cardiomyopathy in an organoid model of human heart development. // Stem Cell Reports (2024), published online 8 February 2024. DOI: 10.1016/j.stemcr.2024.01.003


 Меню
Меню





 Все темы
Все темы



 0
0