Миниатюрная печень в глазу сообщает о состоянии большой печени
Исследователи из Каролинского института подсадили в глаз мышей сфероиды, полученные из гепатоцитов, чтобы отслеживать состояние печени in vivo. Они показали, что сфероиды прикрепляются к радужной оболочке глаза и снабжаются кровеносными сосудами и нервами, необходимыми для их функционирования и выживания. При этом их клетки сохраняют типичные характеристики печени и могут отражать состояние здоровья печени животного.
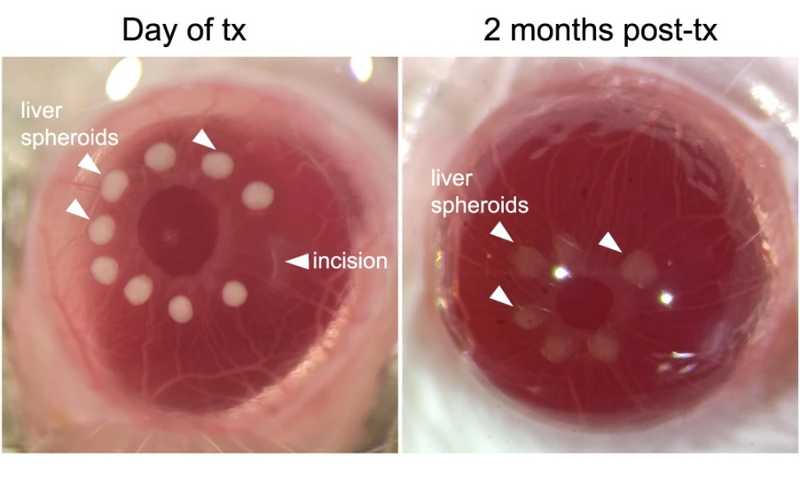
Сфероиды печени, подсаженные в глаз мышам-альбиносам, в день трансплантации (слева) и через два месяца после нее (справа).
Credit:
Nature Communications (2024). DOI:
10.1038/s41467-024-45122-4 |
CC BY
Мониторинг работы печени требует продолжительного изучения in vivo, что предполагает использование методов неинвазивной визуализации, отсутствующих на данный момент. Существующие методы прижизненной визуализации имеют свои ограничения, так как они не позволяют осуществлять регулярное исследование одного и того же животного. Шведские ученые предложили трансплантировать сфероиды печени в переднюю камеру глаза и с их помощью изучать печень на клеточном уровне. Такая платформа имеет ряд преимуществ — большое количество кровеносных сосудов и нервных окончаний в передней камере позволяют эффективно приживляться трансплантированным органам и тканям, а прозрачность роговицы дает возможность проводить прижизненное наблюдение.
Ученые поместили сфероиды печени на радужную оболочку глаза мышей, где они прижились и были с высоким разрешением визуализированы in vivo в режиме реального времени. Анализ выявил постепенную васкуляризацию сфероидов. Через месяц после трансплантации рост сосудов прекращался, и капилляры в сформированной сосудистой сети были по диаметру в три раза меньше, чем капилляры радужки. Такое отличие указывает, что на тип развивающегося сосуда влияет сам трансплантат; это также подтверждается иммунофлуоресцентным окрашиванием ex vivo.
Используя меченые эритроциты во время визуализации in vivo, ученые обнаружили, что сосуды внутри сфероидов печени функционируют в одном направлении с кровотоком мышей. Далее исследователи изучили связь сфероидов печени с нервными окончаниями с помощью окрашивания ex vivo симпатических и парасимпатических маркеров. Они обнаружили, что приживленные сфероиды иннервируются симпатическими нервными окончаниями, которые проходят вдоль сосудов.
Также исследователи наблюдали приток макрофагов в сфероиды печени, что позволяет предположить, что эти клетки набираются из кровотока для заполнения сфероидных трансплантатов.
На следующем этапе авторы решили оценить пригодность используемой платформы для визуализации in vivo. Для этого они проанализировали транскриптом имплантированных сфероидов печени методом секвенирования РНК через два месяца после трансплантации. Когда исследователи сравнили эксплантаты сфероидов с первичными образцами радужки, они обнаружили, что первые сильно обогащены генами клеток печени. В дополнение к этому, анализ по базе данных KEGG выявил сходство с общими путями, характерными для печени. Так, гены, отвечающие за функции печени, имели сопоставимые уровни экспрессии с генами гепатоцитов в сфероидах. Для визуализации типичных печенеподобных микроструктур внутри прижившихся сфероидов авторы провели просвечивающую электронную микроскопию через 2 месяца после трансплантации. Гепатоциты сфероидов имели характерные гранулы гликогена и проявляли клеточную полярность с канальцевидными, латеральными и синусоидальными полюсами.
Анализ транскриптома показал, что прижившиеся сфероиды экспрессируют типичные маркеры, связанные с определенными зонами расположения гепатоцитов. Для определения зональности сфероидов авторы использовали метод FISH. Маркерами гепатоцитов при этом служили гены Hnf4a и Alb, а для определения зон использовались Cyp2f2 (перипортальная зона) и Glul (перицентральная зона). В результате было выявлено, что гепатоциты в приживших сфероидах представлены всеми тремя зонами печени.
Затем ученые проанализировали функционирование гепатоцитов в режиме реального времени. Они изучали экспорт желчных кислот в организме с помощью диацетата 5-хлорметилфлуоресцеина (CMFDA), который поглощается гепатоцитами, выводится ими и накапливается в желчных канальцах. С помощью одновременного использования лектина авторы смогли разграничить сосудистую сеть от сети желчных канальцев и наблюдать хорошо организованную и поляризованную структуру ткани, которая сохранялась в течение шести месяцев после трансплантации. Вскоре после введения CMFDA через хвостовую вену гепатоциты метаболизируют это соединение, превращая его в флуоресцентный CMF-5, который затем выводится гепатоцитами. Этот процесс был визуализирован в желчных канальцах, что позволило выявить полностью развитую сеть канальцев в сфероидах. В эксплантированных сфероидах также обнаружились другие характерные генные сигнатуры, ответственные за функции гепатоцитов, такие как обмен липидов, метаболизм глюкозы и гликогена, комплементарные факторы и факторы свертывания крови, а также метаболизм ксенобиотиков.
Затем авторы исследовали сфероиды печени с помощью флуоресцентных биосенсоров. Ученые трансдуцировали клетки во время формирования сфероидов аденоассоциированным вирусом (AAV8, AAV9), кодирующим GFP, и отслеживали флуоресценцию в течение четырех месяцев после трансплантации. Как считают авторы работы, сфероиды печени, полученные от трансгенных мышей и экспрессирующие флуоресцентные белки, могут быть использованы для решения конкретных исследовательских вопросов. В качестве доказательства ученые получили сфероиды из гепатоцитов трансгенных мышей линии FUCCI, которые позволяют отслеживать клеточный цикл с помощью цветового кодирования клеток в фазах G0/G1 (красный) и S/G2/M (зеленый). Через неделю после трансплантации такие сфероиды проявили сниженную активность клеточного цикла, которая поддерживалась на низком уровне в последующие недели. В этот период исследователи смогли детально изучить различные стадии клеточного цикла в трансплантированных сфероидах печени на уровне единичных клеток. Кроме того, ex vivo иммунофлуоресцентное окрашивание на маркер пролиферации Ki67 показало активность клеточного цикла в гепатоцитах, что подтвердило результаты, полученные в организме.
Далее авторы проверили, будут ли сфероиды реагировать на вызванное диетой накопление липидов в печени аналогично тому, как гепатоциты in situ мышей-реципиентов. Для этого мышей с внутриглазными сфероидами печени в течение 12 недель держали на диете с высоким содержанием жиров и фруктозы, а затем исследовали сфероиды печени путем иммуноокрашивания. Эксперимент показал, что сфероиды печени животных на диете накапливают липидные капли внутри гепатоцитов в тех же количествах и такого же размера, что и гепатоциты эндогенной печени.
Таким образом, внутриглазные сфероиды печени способны получать системные сигналы и реагировать на них, что позволяет прижизненно отслеживать состояние печени в течение продолжительного времени.
Органоиды человека прижились в мозге крысы
Источник
Francesca L.-B., et al. Intraocular liver spheroids for non-invasive high-resolution in vivo monitoring of liver cell function // Nat Commun 15, 767, published 26 Jan 2024. DOI: 10.1038/s41467-024-45122-4


 Меню
Меню





 Все темы
Все темы



 0
0