Молекулярный мониторинг улучшает выживаемость при ОМЛ только у пациентов с мутациями NPM1 и FLT3-ITD
Международное рандомизированное исследование показало, что при остром миелоидном лейкозе (ОМЛ) регулярный молекулярный мониторинг минимальной остаточной болезни не улучшает выживаемость в общей популяции пациентов. Однако в ключевой подгруппе (22% от всех участников), ОМЛ в которой был связан с одновременным наличием мутаций в NPM1 и тандемной дупликации FLT3-ITD, такой подход почти вдвое снизил риск смерти за время исследования. Авторы подчеркивают важность стратификации пациентов по молекулярному подтипу болезни.
В течение многих лет высокочувствительные тесты для выявления минимальной остаточной болезни (МОБ) при остром миелоидном лейкозе (ОМЛ) рассматривались как ценный инструмент раннего предупреждения рецидива. Эти методы способны зафиксировать возвращение заболевания задолго до появления отклонений в стандартных анализах крови или пункции костного мозга. Хотя наличие МОБ после лечения стабильно ассоциировалось с неблагоприятным прогнозом, оставалось неясно, улучшит ли выживаемость изменение лечебной стратегии, сделанное с поправкой на выявленную МОБ.
Чтобы ответить на этот вопрос, команда ученых из Великобритании, Дании и Австралии провела первое в своем роде рандомизированное исследование, объединив данные двух крупных клинических испытаний — UK NCRI AML17 и AML19. Их участниками становились молодые и относительно молодые взрослые пациенты (в основном в возрасте от 16 до 60 лет) с впервые диагностированным острым миелоидным лейкозом, подходящим для интенсивной химиотерапии.
У всех участников проводили поиск специфических молекулярных маркеров, характерных для их подтипа ОМЛ, таких как мутации гена NPM1 или определенные химерные транскрипты. Пациенты, у которых были выявлены такие маркеры и которые соответствовали критериям включения, случайным образом распределялись в соотношении 2:1 в одну из двух групп: группу молекулярного мониторинга МОБ или группу стандартного клинического наблюдения без использования МОБ. В общей сложности в исследовании приняли участие 637 человек: 425 в группе мониторинга и 212 в контрольной группе.
Участникам из группы мониторинга регулярно проводили забор образцов костного мозга и периферической крови: после каждого курса химиотерапии, после трансплантации (если ее проводили), а затем каждые три месяца в течение трех лет. Для анализа применяли высокочувствительные методы, такие как количественная ПЦР с обратной транскрипцией (RT-qPCR), позволяющие обнаружить даже минимальное количество лейкемических клеток.
Результаты тестов передаваль лечащим врачам, которые могли использовать их для принятия решений о дальнейшем лечении, включая возможность раннего вмешательства при обнаружении молекулярного рецидива. При этом протокол не предусматривал жестко регламентированных терапевтических шагов — выбор тактики оставался на усмотрение врача.
Результаты исследования оказались неоднозначными. При медианном сроке наблюдения около пяти лет анализ первичной конечной точки — общей выживаемости — не выявил статистически значимого преимущества молекулярного мониторинга МОБ по сравнению со стандартным клиническим наблюдением. Через три года выживаемость составила 70% в группе мониторинга и 73% в контрольной группе, что не отражало существенной разницы. Этот результат стал основным выводом для всей исследованной когорты пациентов.
Однако в рамках заранее запланированного анализа подгрупп исследователи выявили важное исключение. Значимое преимущество от молекулярного мониторинга МОБ было обнаружено у пациентов с определенным молекулярным профилем — наличием одновременно мутаций в гене NPM1 и внутренней тандемной дупликации (FLT3-ITD). Эта подгруппа составляла около 22% от общего числа участников, включенных в рандомизацию.
У пациентов с таким сочетанием мутаций молекулярный мониторинг был связан с почти двукратным снижением риска смерти. Трехлетняя общая выживаемость в этой группе составила 69% при мониторинге против 58% при стандартном наблюдении. Этот эффект был статистически значимым и контрастировал с результатами как в других подгруппах, так и в общей популяции. Напротив, у пациентов, имевших только мутацию NPM1 (без FLT3-ITD) или только химерные гены, мониторинг МОБ не дал улучшения выживаемости.
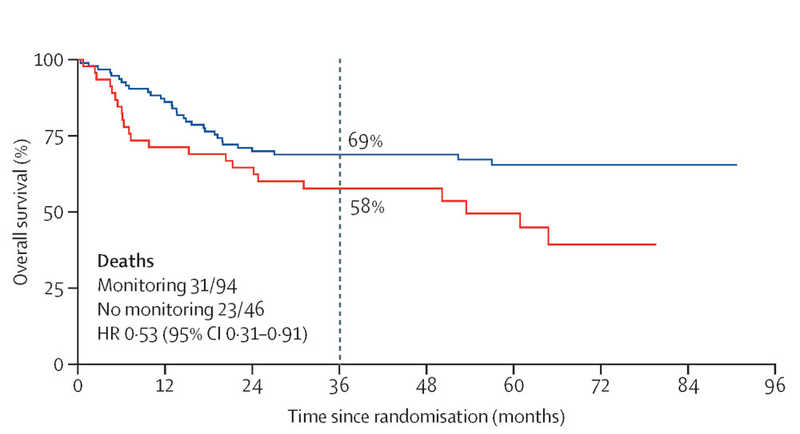 Общая выживаемость у пациентов с мутациями NPM1
и FLT3-ITD, которым проводили (синяя кривая) или не проводили (красная) мониторинг МОБ.
Общая выживаемость у пациентов с мутациями NPM1
и FLT3-ITD, которым проводили (синяя кривая) или не проводили (красная) мониторинг МОБ.Credit:
The Lancet Haematology, 2025. DOI: 10.1016/S2352-3026(25)00037-7 | CC BY
Примечательно, что несмотря на отсутствие улучшения общей выживаемости в общей популяции, молекулярный мониторинг значительно снизил частоту гематологических рецидивов и увеличению выживаемости без клинического рецидива (при этом молекулярные рецидивы не учитывались как событие). Эти данные подтверждают, что мониторинг МОБ способен раньше выявлять возвращение заболевания, однако при существующих лечебных стратегиях это не всегда означает долговременное улучшение выживаемости для всех пациентов.
Исследование проводилось с 2012 по 2018 год, когда основным методом лечения молекулярного рецидива была интенсивная химиотерапия. Отсутствие пользы от мониторинга в других подгруппах, например, с изолированной мутацией NPM1, объясняется хорошим ответом на стандартное лечение при рецидиве. Авторы также отмечают, что с появлением таргетных препаратов, например, ингибиторов FLT3, эффективность мониторинга может повыситься.
Ограничения исследования включают отсутствие строго регламентированных вмешательств на основе данных о МОБ и преимущественно молодую возрастную группу пациентов, что ограничивает применимость результатов для пожилых и менее агрессивно лечащихся пациентов. Тем не менее, проведенная работа стала первым рандомизированным исследованием, оценившим влияние молекулярного мониторинга МОБ на выживаемость при остром миелоидном лейкозе. Она показала, что МОБ не только важна для прогноза, но и служит значимым биомаркером при определенном молекулярном подтипе болезни — в данном случае у пациентов с ОМЛ и мутациями NPM1
и FLT3-ITD —
где раннее вмешательство может существенно повысить шансы на выживание.
Уровень маркера RAD51 вместе с NGS помогает выбрать терапию при метастатическом раке простаты
Источник
Potter, N. et al. Molecular monitoring versus standard clinical care in younger adults with acute myeloid leukaemia: results from the UK NCRI AML17 and AML19 randomised, controlled, phase 3 trials. // The Lancet Haematology 12 (5), e346 - e356. DOI: 10.1016/S2352-3026(25)00037-7


 Меню
Меню





 Все темы
Все темы




 0
0








