Мостиковая рекомбинация обеспечивает редактирование протяженных участков генома
Авторы двух публикаций в Nature охарактеризовали рекомбиназу, которая использует для нацеливания на мишень некодирующую «мостиковую» РНК. Эта РНК связывает одновременно донорный и таргетный сайты, привлекая к ним фермент и облегчая процесс рекомбинации. Ученые продемонстрировали, что мостиковую РНК можно программировать, независимо задавая последовательность таргет-связывающей и донор-связывающей петель, что позволяет проводить вставку длинных целевых фрагментов в геном, их удаление или инверсию. Авторы статей рассчитывают, что описанный механизм ляжет в основу третьего поколения основанных на РНК инструментов для манипуляции геномом.

Credit:
Keith Acari
Биологи давно стремятся разработать методы направленной перестройки длинных последовательностей ДНК. Такая возможность позволила бы вставлять, удалять, инвертировать или перемещать в геномах последовательности длиной в тысячи пар оснований. Поэтому сейчас активно изучаются рекомбиназы и транспозазы, обеспечивающие перестройки длинных последовательностей, однако нацелить эти ферменты на конкретные заданные участки оказалось непросто. Теперь же в Nature вышли две статьи, посвященные механизму действия и структуре «мостиковых рекомбиназ», направляемых молекулой некодирующей РНК и позволяющих таргетно перестраивать длинные участки генома.
Инсерционные последовательности (IS-элементы) — одни из наиболее минимальных автономных мобильных генетических элементов (МГЭ), которые широко представлены у бактерий и архей. Многие IS-элементы кодируют транспозазы, которые используются ими для перемещений по геному.
Элементы семейства IS110 перемещаются по механизму «вырезать и вставить». Промежуточная фаза их транспозиции — это кольцевая форма, и с учетом того, что известно о механизме и жизненном цикле этих МГЭ, транспозазы IS110 правильнее называть рекомбиназами. Исследователи из США и Японии показали, что образование кольцевой формы IS110 приводит к экспрессии некодирующей РНК, формирующей две петли: одна из них распознает донорную ДНК, вторая — таргетную (мишень для инсерции). Ученые обозначили такую молекулу как мостиковую РНК (bridge RNA). Связывая донорную и таргетную ДНК посредством спаривания оснований, такая биспецифическая РНК облегчает рекомбинацию. При этом каждую из связывающих петель можно независимо нацелить на ту или иную последовательность ДНК, что и продемонстрировали авторы работы.
Ученые сосредоточились на одном из представителей семейства — элементе IS621, который встречается у некоторых штаммов Escherichia coli. Проанализировав с помощью секвенирования и микроскопического термофореза малые РНК, они пришли к выводу, что вырезание IS-элемента восстанавливает промотор для экспрессии 177-нуклеотидной некодирующей РНК, которая обладает сродством к рекомбиназе. Оценка консенсусной вторичной структуры этой некодирующей РНК у 103 различных ортологов выявила 5′-шпильку, за которой следуют две дополнительные шпильки с выраженными внутренними петлями. При этом последовательность первой из них была намного менее консервативна, чем второй. Дальнейший анализ позволил исследователям предположить, что 5′-сторона каждой из внутренних петель формирует пары оснований с нижней нитью таргетного или донорного сайта протяженностью 8–9 нуклеотидов, а 3′-сторона образует участок в 4–7 спаренных нуклеотидов с верхней нитью. Самая первая 5’-шпилечная структура усиливает связывание мостиковой РНК с рекомбиназой.
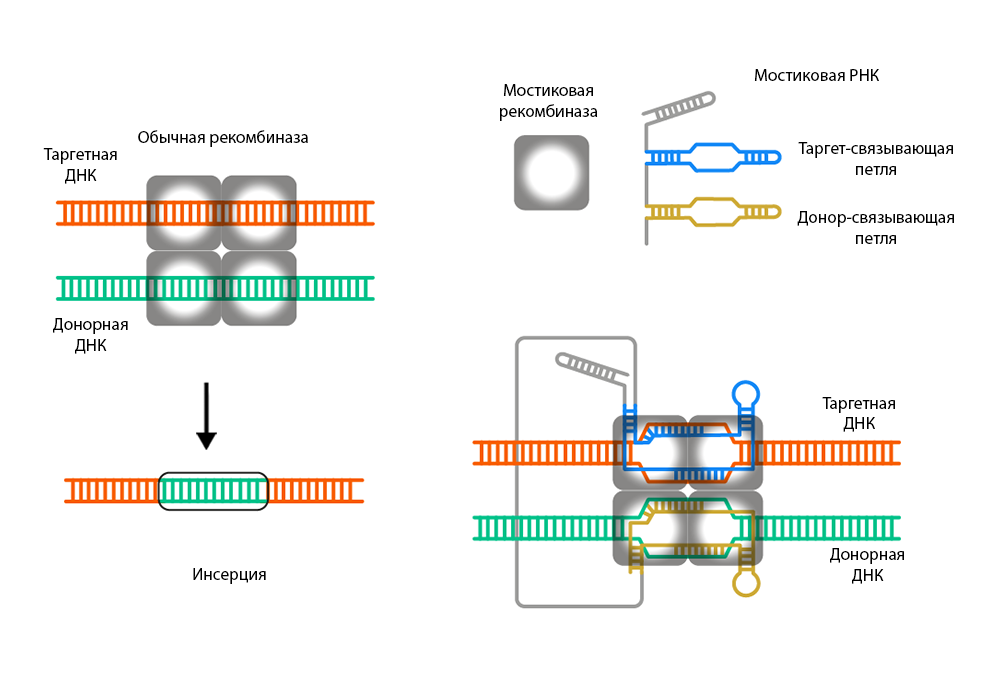 Обычные рекомбиназы распознают целевые сайты с помощью взаимодействий белок-ДНК. Процесс мостиковой рекомбинации основан на привлечении рекомбиназы к таргетному и донорному сайту с помощью молекулы некодирующей (мостиковой) РНК, которая связывает оба сайта.
Обычные рекомбиназы распознают целевые сайты с помощью взаимодействий белок-ДНК. Процесс мостиковой рекомбинации основан на привлечении рекомбиназы к таргетному и донорному сайту с помощью молекулы некодирующей (мостиковой) РНК, которая связывает оба сайта.Credit:
Keith Acari
Более подробно структуру такого комплекса и механизм обеспечиваемой им рекомбинации рассмотрели в другой статье в Nature. Ученые провели анализ с помощью криоэлектронной микроскопии высокого разрешения, сосредоточившись на этапе инсерции. Нуклеотиды 34–38 мостиковой РНК образуют таргет-связывающую петлю (TBL), нуклеотиды 110–177 аналогичным образом формируют донор-связывающую петлю (DBL). Tnp-домен рекомбиназы дестабилизирует дуплекс ДНК, способствуя узнаванию мостиковой РНК таргетного и донорного сайтов. Важную роль в этом процессе играют три консервативных гидрофобных остатка в Tnp-домене — Y264, M265 и M268.
Выявленный механизм распознавания таргетной и донорной ДНК предполагает возможность его программирования. Чтобы оценить его перспективность и применимость, авторы первой статьи создали репортерную систему рекомбинации в E. coli: плазмида pTarget кодировала рекомбиназу IS621, 50-нуклеотидный таргетный сайт и промотор, а pDonor — мостиковую РНК и GFP. Рекомбинация pDonor в pTarget в такой системе помещает ген gfp под промотор, и клетки, где это событие произошло, можно детектировать с помощью проточной цитометрии. Авторы действительно обнаружили экспрессию GFP и подтвердили наличие ожидаемого продукта рекомбинации с помощью нанопорового секвенирования.
Чтобы оценить специфичность IS621 дикого типа, ученые провели вставку неспособной к репликации плазмиды, несущей 22-нуклеотидную донорскую последовательность, в геном E. coli. Картирование выявило 173 уникальных сайта, 144 из которых лежали в пределах повторяющихся внегенных палиндромных последовательностей (REP-элементов) — известных мишеней IS621.
Затем авторы работы нацелили мостиковые РНК на последовательности, встречающиеся в геноме кишечной палочки только один раз. Каждый сайт проверяли с двумя вариантами мостиковой РНК — один содержал короткий (4 нуклеотида) участок петли, связывающий верхнюю нить таргетной последовательности (RTG-участок), второй нес удлиненный (7 нуклеотидов). Частота вставок в целевой сайт составила 51,6–94,0%, а наиболее часто обнаруживаемые сайты внецелевой активности обычно отличались от ожидаемой мишени на 1–2 нуклеотида. При этом удлиненный вариант повысил среднюю специфичность вставки с 69,4% до 84,9%.
Донорная последовательность консервативнее таргетной, и авторы предположили, что донор-связывающую петлю будет сложнее перепрограммировать, чем таргет-связывающую. Однако скрининг тысяч пар «донорная последовательность—донор-связывающая петля» показал, что это не так.
Помимо вставки фрагментов ДНК в геном, рекомбиназы могут применяться для удаления или инверсии последовательностей. Авторы протестировали способность рекомбиназы IS621 производить такие перестройки. Они создали GFP-репортерные системы и протестировали в них четыре пары донорных и таргетных сайтов. Как вырезание, так и инверсия происходили эффективно (в 32,2–98,9% и 4,54–98,2% всех клеток, соответственно).
Авторы заключают, что способность рекомбиназ семейства IS110 и их мостиковых РНК вставлять, вырезать и инвертировать последовательности в геноме программируемым и специфичным образом позволяет контролировать несколько типов перестроек ДНК с помощью единой системы. Они ожидают, что описанный ими механизм мостиковой рекомбинации поспособствует появлению третьего поколения основанных на РНК инструментов для манипуляции геномом, дополнив уже существующие системы РНК-интерференции и CRISPR.Источники
Durrant, M.G., et al. Bridge RNAs direct programmable recombination of target and donor DNA. //Nature 630, 984–993 (2024). DOI: 10.1038/s41586-024-07552-4
Hiraizumi, M., et al. Structural mechanism of bridge RNA-guided recombination. // Nature 630, 994–1002 (2024). DOI: 10.1038/s41586-024-07570-2


 Меню
Меню





 Все темы
Все темы




 0
0








