На клетках солидных опухолей разместили мишени для CAR-T терапии
Американские исследователи ввели усеченный антиген CD19 в клетки солидных опухолей с помощью онколитического вируса. Этот белок экспрессируется на поверхности опухолевых клеток и становится мишенью для CD19-CAR-T клеткок. В эксперименте на мышах совместное введение вируса и CD19-CAR T привело к полной регрессии опухолей и формированию противоопухолевого иммунитета.
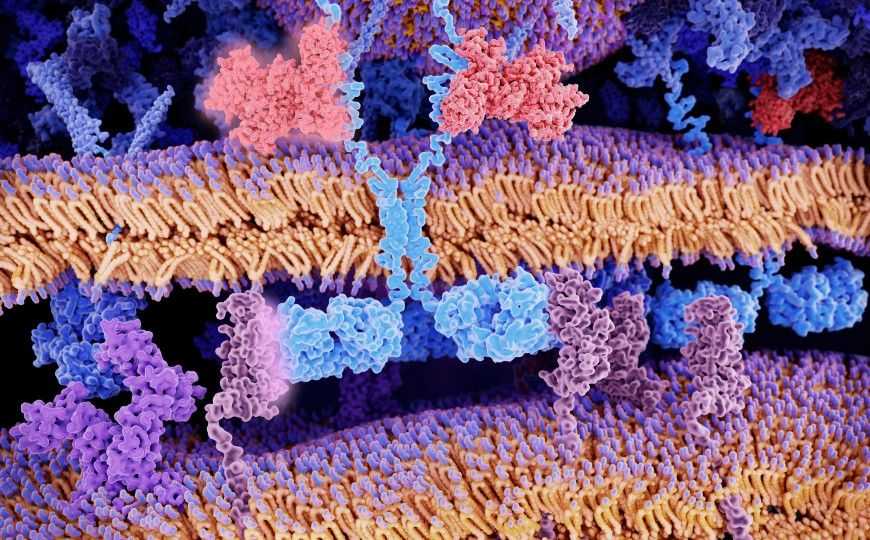
Химерные антигенные рецепторы CAR на поверхности T-клетки (светло-голубой) специфически связываются с молекулами антигена CD19 (розовый) на лейкозной клетке
Credit:
Juan Gaertner | 123rf.com
Терапия CAR-T клетками работает против B-клеточных лимфом и лейкозов, экспрессирующих антиген CD19. Однако у солидных опухолей зачастую нет характерного, гомогенно экспрессируемого антигена, который может быть мишенью для CAR-T.
Исследователи из центра City of Hope (Дуарти, США) доставили антиген в опухоль с помощью онколитического химерного ортопоксовируса. Онколитические вирусы сами по себе являются многообещающими инструментами лечения солидных опухолей, но разрабатываются также комбинированные подходы, в которых вирусы используются для повышения эффективности клеточной иммунотерапии. В данном случае в геном ортопоксвируса вставили ген усеченного CD19 (CD19t) под ранний промотор, который гарантирует синтез белка и его появление на мембране клеток до их гибели из-за инфекции.
Для проверки вируса OV19t in vitro авторы инфицировали клеточную культуру трижды негативного рака молочной железы разными дозами и оценивали экспрессию белка и выживаемость клеток. Через трое суток при самой низкой дозе почти 100% клеток содержали CD19t, половина осталась жива. Опухолевые клетки других линий также экспрессировали белок после инфекции вирусом.
При сокультивировании инфицированных OV19t опухолевых клеток с CD19-CAR T-лимфоцитами у последних появлялись маркеры активации, они синтезировали провоспалительные цитокины. Также присутствие CAR-T в несколько раз повысило смертность клеток после инфицирования OV19t. В случае инфекции клеток вирусом без гена CD19t подобных эффектов не было. Интересно, что при гибели опухолевые клетки выделяли вирусные частицы, которые инфицировали наивные клетки — это дает возможность гомогенно инфицировать всю опухоль внутри организма.
Работу системы проверили in vivo на ксенографтной подкожной опухоли у мышей: в нее вводили OV19t, спустя 10 дней — CD19-CAR T. В качестве контроля использовали Т-клетки без CD19-CAR. При инъекции только вируса или вируса и обычных Т-клеток наблюдали замедление роста опухоли, в случае комбинированной терапии — значительную регрессию опухоли.
Далее авторы полностью воспроизвели систему на мышах: в вирус вставили мышиный CD19t (OVm19t), CD19-CAR T сделали на основе лимфоцитов из селезенки животных и проверили эффективность метода на исходно мышиной опухоли (MC38). При введении только OVm19t полная регрессия была в 22% случаев, при инъекции вируса и mCD19-CAR T — в 60%. В случае перитонеальных метастазов вирус и клетки вводили в брюшную полость, что остановило распространение опухоли и повысило выживаемость. Также авторы показали, что введение OVm19t стимулирует эндогенный иммунитет: происходила инфильтрация опухоли собственными цитотоксическими Т-лимфоцитами. При повторном введении опухолевых клеток вылеченным мышам опухоль не развивалась, что говорит о формировании специфической противоопухолевой иммунной памяти.
Исследователи также планируют использовать онколитические вирусы для экспрессии ингибиторов иммунных чекпойнтов, цитокинов и хемокинов, чтобы повысить эффективность работы CAR T-клеток.
Источник
A.K.Park, et al. // Effective Combination Immunotherapy using Oncolytic Viruses to Deliver CAR Targets to Solid Tumors // Science Translational Medicine, 2020; DOI: 10.1126/scitranslmed.aaz1863


 Меню
Меню





 Все темы
Все темы




 0
0








