Нанотранспортеры из ДНК увеличивают время жизни препарата в крови мыши
Исследователи из Канады и Франции создали новые нанотранспортеры для доставки лекарств. Они работают как молекулярные буферы, которые поддерживают концентрацию свободного препарата на постоянном уровне, а также как резервуары препарата. Нанотранспортеры выполнили из ДНК для легкости синтеза и модификации. Эффективность продемонстрировали на мышах — молекулярные буферы увеличили время жизни доксорубицина в крови и снизили некоторые побочные эффекты.
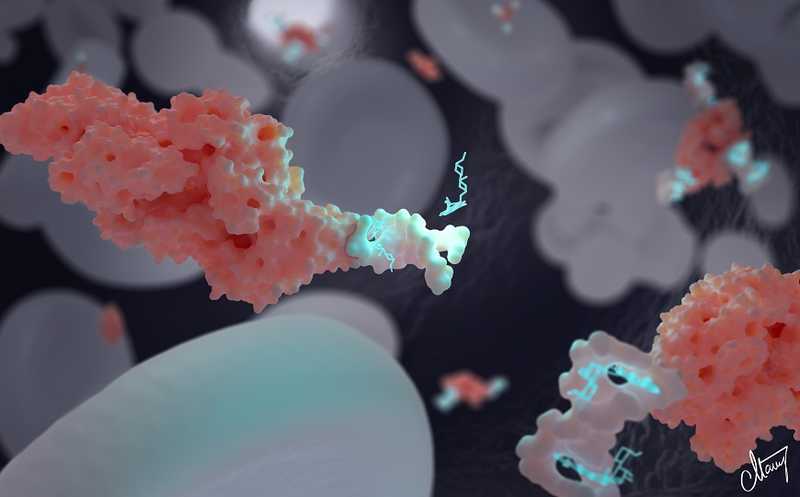
Нанотранспортер (белый) присоединен к альбумину (розовый) для поддержания концентрации доксорубицина (голубой) в крови.
Credit:
Illustration : Monney Medical Media / Caitlin Monney | Пресс-релиз
При лечении заболеваний очень важно достигнуть и поддерживать оптимальную концентрацию лекарств. Слишком низкая концентрация снижает эффективность, а слишком высокая — повышает вероятность развития побочных эффектов. Большинство препаратов довольно быстро деградируют, и пациентам нужно регулярно принимать лекарства через регулярные интервалы. Однако люди не всегда точно выполняют предписания. Намного лучше использовать систему для доставки лекарств, которая бы сама, основываясь на сигналах из окружающей среды, выпускала препарат, когда это необходимо. Живые организмы используют белковые транспортеры, чтобы поддерживать точную концентрацию ключевых биомолекул, таких как гормоны щитовидной железы. Исследователи из Канады и Франции имитировали эти процессы для создания искусственных транспортеров лекарств.
Белковые транспортеры действуют как молекулярные буферы, они поддерживают концентрацию молекул с помощью механизма, похожего на pH-буфер. Равновесие между комплексом и свободной молекулой смещается под влиянием изменений концентрации последней. На этом же принципе основана работа новых нанотранспортеров, которые выполнены из ДНК. В отличие от белков, ДНК легче синтезировать, модифицировать и использовать.
Авторы получили ДНК-аптамер Q0 для доставки хинина, противомалярийного препарата, и ДНК-связывающую последовательность D0 для доставки доксорубицина. Они показали in vitro, что эти молекулярные буферы могут поддерживать концентрацию свободных лекарств на постоянном уровне при большой разнице в общей концентрации лекарств. Буферную емкость определяют с помощью титрования. Ученые определили буферные зоны и KD для новых молекулярных буферов. Они также показали, что KD можно изменять, модифицируя нанотранспортеры.
Свойства буферов подразумевают, что за раз можно вводить большую дозу препарата. Сначала авторы проверили это утверждение in vitro. Они взяли две клеточные линии и определили для них и доксорубицина IC50. Присутствие буфера значительно повышало концентрацию общего доксорубицина, которую могли переносить клетки. Сами молекулярные буферы не были токсичны.
Молекулярные буферы не только поддерживают концентрацию свободного лекарства, но и работают как резервуар, что значительно снижет частоту введения препарата. А управляя скоростью деградации буфера, можно создать персонализированный фармакокинетический профиль. В опытах in vitro увеличение скорости деградации транспортера вело к повышению концентрации свободного препарата. Скорость можно варьировать, изменяя свойства молекулярного буфера.
Далее авторы перешли к опытам на мышах. Они показали, что буфер позволяет сильно продлить время жизни доксорубицина. Также можно управлять биораспределением лекарств: буфер позволяет увеличить время, которое препарат проводит в крови. Также снижалась токсичность доксорубицина, и мыши лучше набирали вес. Интересно, что у мышей, которым вводили комплекс, увеличивалась частота сердцебиения. Этого не происходило при введении самих молекулярных буферов. Авторы объясняют увеличение скорости сердцебиения без потери веса большим временем жизни доксорубицина в крови. Воздействие доксорубицина на биомаркеры сердца и почек не зависело от способа введения.
По мнению авторов, их транспортеры можно использовать в случае, если нужно ввести препарат с маленьким терапевтическим окном, или если сложно подобрать терапевтическую дозу. Также можно повлиять на биораспределение и даже снизить резистентность, поддерживая концентрацию препарата. Исследователи также приводят советы по подбору молекулярных буферов.
Алексис Валли-Белисле, доцент Монреальского университета и соавтор статьи, комментирует: «Можно разработать схожие нанотранспортеры для доставки препаратов в другие области тела и повышения концентрации препаратов в опухолях. Это значительно увеличит эффективность лекарств и снизит их побочные эффекты».
Источники:
Arnaud Desrosiers, et al. Programmable self-regulated molecular buffers for precise sustained drug delivery // Nature Communications, 13, 6504 (2022), published November 02, 2022, DOI: 10.1038/s41467-022-33491-7
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0








