Напечатанная на 3D-принтере кора больших полушарий прижилась в эксплантах мозга мышей
Пересадка выращенных из клеток пациента тканей головного мозга могла бы восстанавливать неизлечимые на сегодняшний день повреждения, однако до сих пор не сообщалось о восстановлении правильной архитектуры нейронов при пересадке отдельных клеток модельным животным. Оксфордские ученые приблизились к решению этой проблемы — они напечатали двухслойную модель коры больших полушарий на 3D-принтере и показали, что такая структура успешно приживается в эксплантах мозга мышей.
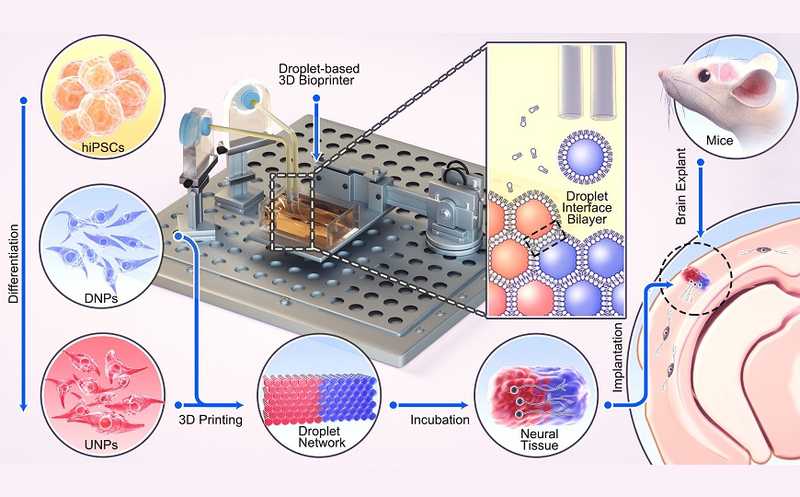
С помощью 3D-печати сформировали двухслойную ткань коры головного мозга из капель, содержащие нейрональные предшественники, которые предварительно получили из индуцированных плюрипотентных стволовых клеток человека. После культивирования в течение суток конструкции имплантировали в мозг мыши. DNP — нейронные предшественники глубоких слоев; UNP — нейронные предшественники верхних слоев.
Credit:
Yongcheng Jin, University of Oxford | Пресс-релиз
Технология 3D-печати живых тканей перспективна для восстановления поврежденных органов и их участков. Одно из таких развивающихся и активно исследуемых направлений — замещение с ее помощью поврежденных участков мозга. Недавно оксфордские ученые создали образец коры головного мозга из индуцированных плюрипотентных стволовых клеток человека (hiPSC) и приживили его на срез мозга мыши.
Кора головного мозга обычно имеет шестислойную архитектуру, состоящую из специфичных для каждого слоя нейронов. Слои I–IV обозначаются как верхние, а слои V–VI — как глубокие. Авторы работы, опубликованной в Nature Communications, предположили, что имплантация тканей, напоминающих клеточную архитектуру коры, окажется эффективнее, чем пересадка отдельных клеток и органоидов, лишенных сложной структуры.
Чтобы напечатать ткань, приближенную по архитектуре к коре головного мозга, авторы работы дифференцировали hiPSC в два подтипа нейрональных предшественников — верхнего и глубокого слоев. Из этих предшественников с помощью трехмерной капельной печати получили несколько слоев, состоящих из клеток и внеклеточного матрикса. Клетки-предшественники в такой структуре прошли созревание, в том числе терминальную дифференцировку, а также сформировали отростки.
Нейрональные предшественники глубокого слоя авторы получили путем дифференцировки с двойным ингибированием SMAD (они применяли ингибиторы LDN193189 и SB431542). Полученные из hiPSC клетки нейроэктодермы последовательно культивировали в средах для дифференцировки — из них сформировали нейрональные предшественники, которые затем выращивали в среде для терминальной дифференцировки, ингибирующей активацию Notch. Его ингибирование переключает дифференцировку с глиального пути на нейрональный. Через 10 дней такой культивации (суммарно дифференцировка заняла 29 дней) клетки приобрели черты зрелых нейронов: они обладали поляризованной морфологией и экспрессировали маркер глубоких слоев коры CTIP2. При этом уровень маркеров среднего (SATB2) и верхнего слоев (CUX1 и BRN2) был низким.
На более поздних этапах нейрогенеза коры головного мозга из радиальной глии образуются нейроны, которые мигрируют в кортикальную пластинку, проходя через глубокий слой, и становятся нейронами верхнего слоя. Их получение из клеток-предшественников требовало более длительного протокола. Сперва клетки-предшественники стимулировали коктейлем факторов роста, поддерживающими пролиферацию (FGF-2 и EGF) и созревание (BDNF). В таких условиях клетки сохраняли прогениторную морфологию до 40-го дня. Следующие 10 дней их культивировали в среде для терминальной дифференцировки, после чего они приобрели морфологию зрелых нейронов верхних слоев коры. Иммунофлуоресцентное окрашивание на 50-й день дифференцировки выявило экспрессию маркеров верхнего слоя CUX1, CUX2 и BRN2, а также маркера среднего и верхнего слоя SATB2, тогда как экспрессия CTIP2 оказалась слабой.
Подтвердив эффективность методов дифференцировки нейронов верхних и глубоких слоев коры в культуре, авторы работы перешли к созданию трехмерных структур. Для изготовления двухслойной модели коры головного мозга они выбрали клетки-предшественники каждого из слоев. Именно их, а не зрелые нейроны, ученые решили использовать потому, что клетки-предшественники менее чувствительны к диссоциации из монослойной культуры, а также более компактны — это упрощает работу с ними при 3D-печати живых тканей.
Формирование отростков и миграция нейронов — два важных явления в кортикальном нейрогенезе. Авторы убедились в том, что после двух недель культивирования напечатанные ткани коры головного мозга сохраняли двухслойную архитектуру. Сравнение тканей через 2, 4 и 8 недель после печати выявило также миграцию нейронов и образование отростков. Кроме того, проанализировав экспрессию соответствующих маркеров, исследователи подтвердили созревание нервной ткани.
Следующим важным шагом стала трансплантация напечатанных структур в экспланты мозга мышей. Уже известно, что культивируемые экспланты сохраняют архитектуру мозга и функциональность клеток в условиях ex vivo. На таких эксплантах ученые проверяли способность искусственных фрагментов коры восстанавливать повреждения. Для этого они получали кортикальные ткани описанным выше способом, культивировали их в течение суток и подсаживали в подготовленные экспланты, в которых предварительно создавали повреждение диаметром около 800 мкм. На пятый день после трансплантации выживало около 86% клеток. С помощью флуоресцентной конфокальной микроскопии исследователи показали формирование клеточных отростков и миграцию нейронов имплантированной ткани — это подтверждает, что напечатанные фрагменты коры интегрировались в эксплант мозга.
Авторы исследования также подтвердили функциональность пересаженной структуры в составе экспланта. Для функционирования мозга необходима согласованная активность нейронов, которую можно отслеживать по пикам концентрации ионов кальция. Ученые проанализировали ее с помощью кальциевого сенсора Fluo-4 и обнаружили спонтанные кальциевые колебания как в имплантированной структуре, так и в самом экспланте мозга. Дальнейшая визуализация Ca2+ показала наличие корреляции между активностью клеток: она происходила как внутри импланта и экспланта-«хозяина», так и на границе между ними. Эти результаты подтверждают не только структурную, но и функциональную интеграцию после пересадки.
Трансплантация диссоциированных человеческих нейронов в мозг мыши уже была описана в нескольких исследованиях, которые продемонстрировали выживаемость введенных клеток, и образование связей между ними и мозгом хозяина. Однако в предыдущих работах не было продемонстрировано, что трансплантация диссоциированных клеток восстанавливает архитектуру утраченной ткани — а именно к этому приблизились авторы настоящей работы. Их достижения могут использоваться в будущих исследованиях, направленных на создание более реалистичных тканей коры. В перспективе такой метод способен обеспечить восстановление тканей мозга после повреждений, которые неизлечимы в настоящее время.
Источник
Jin, Y., et al. Integration of 3D-printed cerebral cortical tissue into an ex vivo lesioned brain slice // Nature Communication (2023). DOI: 10.1038/s41467-023-41356-w


 Меню
Меню





 Все темы
Все темы




 0
0








