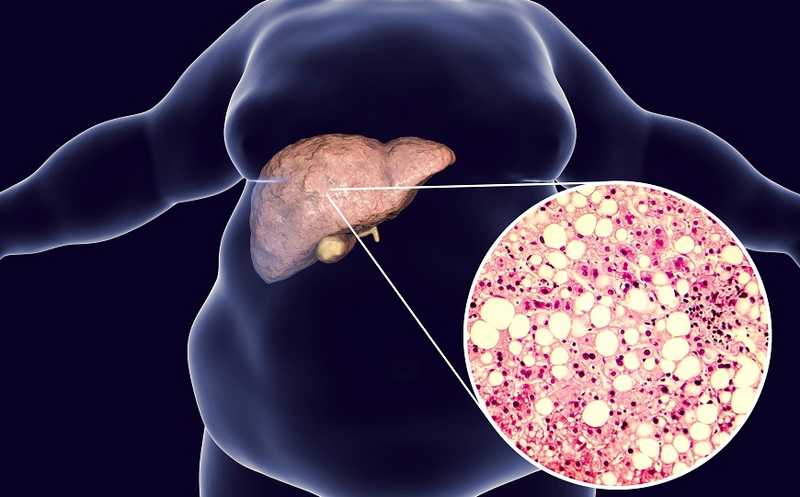
Неалкогольную жировую болезнь печени можно контролировать через Lin28
Исследователи из Швейцарии показали, что малая молекула C1632 — ингибитор РНК-связывающих белков Lin28 — активирует кетогенез в клетках печени мышей и подавляет de novo липогенез. У двух мышиных моделей неалкогольной жировой болезни печени эта малая молекула предотвращала накопление липидов.
Гомологи LIN28 (Lin28A) и LIN28B (Lin28B) — высококонсервативные РНК-связывающие белки, которые координируют сигнальные сети, важные для эмбрионального развития, опухолеобразования, регенерации тканей и метаболизма. Белки Lin28 связывают консервативные сайты в 3’UTR мРНК, регулируя их трансляцию, а также терминальные петли прекурсоров let-7, блокируя их процессирование в зрелые микроРНК. мРНК Lin28, в свою очередь, являются таргетами let-7, образуя двойную отрицательную обратную связь.
При оверэкспрессии Lin28A у мышей повышается чувствительность к инсулину и толерантность к глюкозе, а оверэкспрессия let-7 ведет к обратному фенотипу. Повышенный уровень Lin28 отмечают во многих опухолях. Ученые считают Lin28/let-7 привлекательной целью для фармакологического регулирования, особенно при заболеваниях, ассоциированных с нарушениями в сигнальных путях PI3K и mTOR.
В предыдущих работах исследователи из Швейцарии провели скрининг 16 000 соединений и идентифицировали малую молекулу C1632. Она не дает Lin28 связывать прекурсоры let-7. Авторы показали, что C1632 можно использовать in vivo. В новой работе исследователи продемонстрировали, что ингибирование Lin28 этой малой молекулой влияет на метаболизм мышей, активируя кетогенез и подавляя de novo липогенез в печени.
Сначала авторы вводили C1632 мышам через внутрибрюшинные инъекции. У животных слегка повышался уровень глюкозы в крови. Уровни Lin28A и Lin28B при этом снижались на 20% и 40% в печени и на 30% и 60% в скелетных мышцах. Дальнейший анализ показал, что C1632 подавляла сигнальный путь инсулин-PI3K-mTOR. Полученные in vivo результаты повторили in vitro на человеческих и мышиных клетках.
C1632 не влияла на вес мышей, но через пять дней от некоторых животных начинал исходить запах ацетона, ассоциированный с кетогенезом — образованием кетоновых тел через бета-окисление жирных кислот в митохондриях печени. Кетоновые тела катаболизуются, чтобы поддержать метаболизм важнейших органов при недостатке глюкозы. Повышение кетогенеза ассоциировано с нарушением сигнального пути инсулин-PI3K-mTORC1.
Активацию кетогенеза подтвердили у мышей, получавших C1632. Кетогенез контролируется транскрипционным фактором PPARα. В печени NCoR1 ингибирует PPARα, аттеньюируя кетогенез. У мышей, получавших C1632, уровень NCoR1 в печени был понижен примерно в два раза. Авторы показали, что Lin28/let-7 регулируют экспрессию NCoR1; ингибирование NCoR1 восстанавливает экспрессию ферментов, опосредованную PPARα, и активирует кетогенез.
Баланс между липогенезом и катаболизмом жирных кислот поддерживает гомеостаз липидов на уровне клеток и организма. Нарушение баланса ведет к таким заболеваниям, как неалкогольная жировая болезнь печени (НАЖБП) и стеатогепатит, для которых характерно патологическое накопление липидов в печени. Авторы предположили, что фармакологическое подавление Lin28 может повысить кетогенез и подавить липогенез в печени. На клеточной модели стеатоза печени они показали, что малая молекула C1632 подавляла экспрессию ферментов, вовлеченных в синтез жирных кислот и триглицеридов, и активировала экспрессию ферментов, связанных с бета-окислением и кетогенезом.
На мышиной модели НАЖБП (с нокаутом Pten в печени) авторы изучили действие C1632 in vivo. Введение этой малой молекулы снижало размер капелек жира в клетках печени, а также число и размер больших капелек; при этом понижался уровень триглицеридов печени. В целом соединение C1632 смещало жировой гомеостаз печени к более здоровому состоянию. Схожие результаты получили на мышах, у которых НАЖБП вызвали диетой.
По мнению авторов, фармакологическое ингибирование Lin28 — потенциальная альтернатива изменению диеты при НАЖБП, которая лучше поддается контролю. На следующем этапе они предлагают подобрать новые, более сильные и селективные ингибиторы Lin28.
Клетки-защитники: как макрофаги участвуют в жировой болезни печени
Источник:
Evangelia Lekka, et al. Pharmacological inhibition of Lin28 promotes ketogenesis and restores lipid homeostasis in models of non-alcoholic fatty liver disease // Nature Communications 13, 7940 (2022), published December 26, 2022, DOI: 10.1038/s41467-022-35481-1


 Меню
Меню





 Все темы
Все темы




 0
0