Немембранные органеллы помогают бактериям пережить стресс
Китайские и британские ученые детально исследовали немембранные белковые структуры, которые формируются в цитоплазме бактерий за счет разделения фаз на границе жидкость-жидкость. Авторы статьи в Science Advances выявили эти органеллы у нескольких видов бактерий и установили, что они участвуют в ответе на стресс.
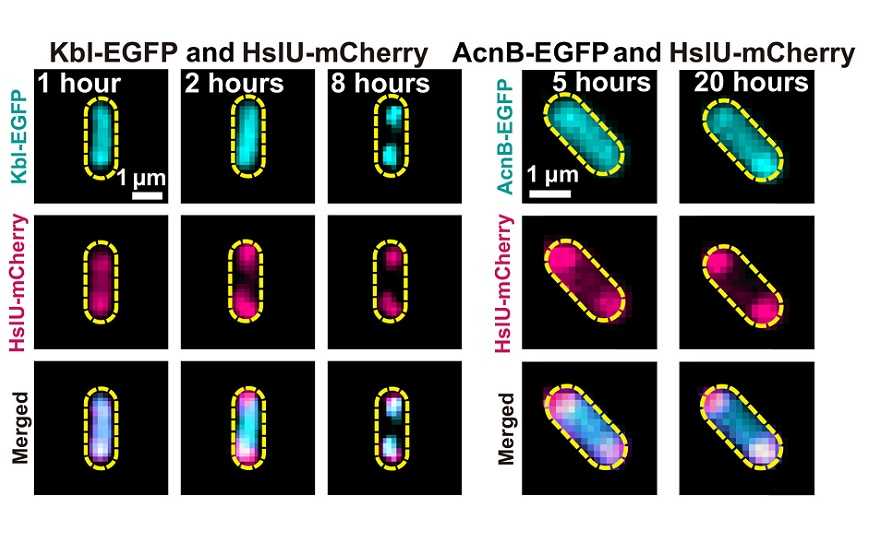
Белки HslU, Kbl и AcnB с флуоресцентными метками позволяют следить за образованием агресом — скоплений белков, которые помогают кишечной палочке пережить стресс.
Credit:
Science Advances, DOI: 10.1126/sciadv.abh2929 | CC BY-NC 4.0
Разделение фаз на границе жидкость-жидкость (liquid-liquid phase separation, LLPS) лежит в основе формирования и поддержания целостности многих немембранных органелл у эукариот: P-гранул, ядрышек, стресс-гранул и других. Несколько недавних исследований показали, что формирование биомолекулярных конденсатов за счет LLPS возможно и у бактерий. Авторы новой работы, опубликованной в Science Advances, показали, что агресомы — динамические скопления белков, которые формируются в условиях стресса и разбираются при переносе бактерий в нормальную среду — образуются за счет LLPS и участвуют в адаптации клеток бактерий к стрессовым условиям.
Авторы работы наблюдали за агресомами с помощью оптической микроскопии высокого разрешения. В качестве биомаркеров агресом они использовали белки HslU, Kbl и AcnB, присутствие которых в агресомах было показано в предыдущих исследованиях, и пометили их флуоресцентными метками. Для запуска образования агресом в клетках Escherichia coli авторы оверэкспрессировали белок HokB, что вызывало нехватку АТФ в клетке. Оказалось, что динамика включения HslU, Kbl и AcnB в состав агресом различается: HslU перемещался в агресомы быстрее других и в наибольших количествах. В дальнейшем именно его использовали как биомаркер агресом.
Наблюдения за HslU показали, что этот белок сохраняет подвижность внутри агресом, что подтверждает их жидкую природу. На основании наблюдений за агресомами с помощью эпифлуоресцентной микроскопии со сканированием каждые две минуты, а также 3D-реконструкции агресом методом STORM авторы работы заключили, что крупные агресомы формируются за счет слияния более мелких капель, содержащих белок HlsU. Добавление к клеткам 1,6-гександиола, который приводит к разборке жидких, но не твердых структур внутри клетки, вызывало разборку агресом, что также свидетельствует в пользу их формирования по механизму LLPS. Авторы работы создали модель, описывающую динамическую природу агресом.
Агресомы не уникальны для E. coli: авторы обнаружили их еще у восьми видов грамотрицательных бактерий. Чтобы изучить физиологическую роль агресом, они подобрали условия, в которых формирование агресом невозможно. Эти условия включают добавление в среду Mops (стабилизатора белков, предотвращающего их агрегацию), а также делеции генов белков респираторной цепи sdhC и nuoA, отключение которых ингибирует внутриклеточное снижение АТФ. Клетки без агресом гораздо хуже справлялись с неблагоприятными воздействиями, чем нормальные клетки, например, хуже выживали в среде с антибиотиками. Очевидно, образование белковых скоплений за счет LLPS помогает бактериям переносить стрессовые условия.
Источник
Xin Jin, et al. Membraneless organelles formed by liquid-liquid phase separation increase bacterial fitness // Science Advances, published 20 October 2021, Vol 7, Issue 43, DOI: 10.1126/sciadv.abh2929.


 Меню
Меню





 Все темы
Все темы




 0
0








