Новый подход в сортировке лимфоцитов для адоптивной иммунотерапии
Канадские ученые предложили сортировать опухоль-инфильтрирующие лимфоциты при помощи антител, помеченных магнитными наночастицами. Новая модульная микрофлюидная система позволяет разделять клетки на субпопуляции в зависимости от уровня экспрессии целевых маркеров. Авторы работы выделили субпопуляцию лимфоцитов, эффективную для адоптивной иммунотерапии онкозаболеваний у модельных мышей.
Опухоль-инфильтрирующие лимфоциты (tumour-infiltrating lymphocytes, TIL) — иммунные клетки, которые накапливаются внутри опухоли. Такие клетки несут на себе большое количество распознающих опухоль рецепторов. В последнее время TIL стали основой для перспективного подхода в иммунотерапии онкологических заболеваний: у пациента удаляют опухоль, выделяют из нее лимфоциты, культивируют их in vitro и затем возвращают больному. TIL обладают высокой цититоксичностью по отношению к раковым клеткам и почти не воздействуют на здоровые ткани. Несмотря на успех терапии в клинических испытаниях, она пока не может быть доступна большому количеству пациентов, так как существующие способы сортировки клеток на субпопуляции в зависимости от экспрессии молекулярных биомаркеров либо недостаточно надежны, либо не позволяют выделить достаточное количество клеток (для клинического использования необходимы миллиарды клеток). Например, сортировка клеток с активированной флуоресценцией (FACS) позволяет собрать всего 30–50% целевых клеток, а магнитная сортировка (MACS) зачастую слишком неспецифична и отбирает большое количество мертвых клеток. К тому же MACS — бинарная техника отбора, она эффективна только для группировки клеток по наличию или отсутствию маркера.
Ученые из Канады предложили соединить иммуномагнитную маркировку клеток и микрофлюидную сортировку. Суспензию клеток помечают антителами, соединенными с магнитными наночастицами. Используемые антитела специфичны к маркеру, который экспрессируется на нужных иммунных клетках, но не вырабатывается опухолевыми клетками (например, CD8 или CD39). Затем клетки сортируются в зависимости от намагниченности, причем можно выбрать клетки с определенным уровнем экспрессии маркера (а не только с экспрессией и без). Устройство печатается на 3D-принтере. Заявленная себестоимость — около десяти долларов, и один человек может создать до 40 чипов в день. Модульная конструкция позволяет настраивать разрешение сортинга при помощи внешних магнитов. Новый подход назвали MATIC (microfluidic affinity targeting of infiltrating cells).
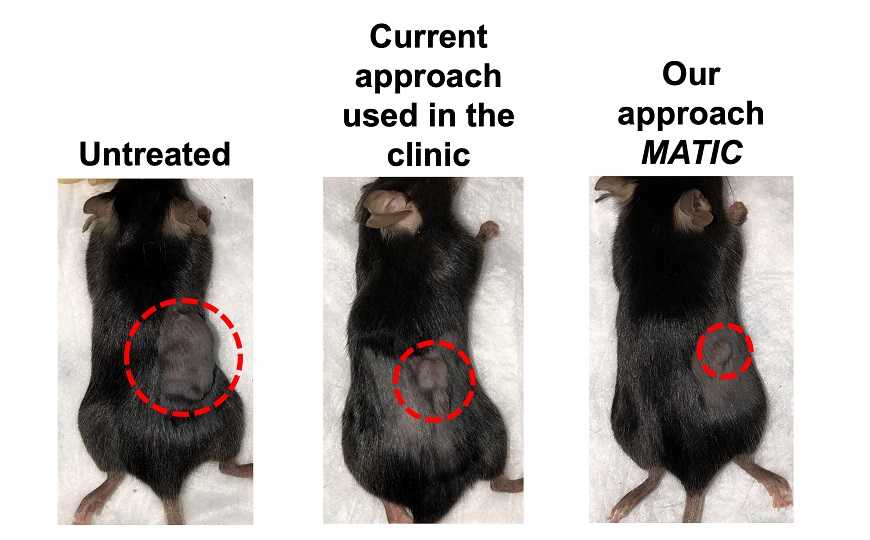
Для начала исследователи проверили эффективность метода, отбирая иммунные клетки из образцов опухолей мышей по маркеру CD8. Чистота полученных образцов составила 98%, при этом микрофлюидному сортеру удалось собрать в 5–30 раз больше клеток, чем MACS/FACS. Кроме того, введение мышам одинакового количества лимфоцитов показало, что терапевтический эффект у собранных микрофлюидным сортером клеток был выше, чем у полученных при помощи MACS. Отобранных FACS клеток не хватило для проведения экспериментов с таким же количеством лимфоцитов.
Далее ученые попробовали выделить отдельные субпопуляции клеток. Так, например, и CD39+, и CD39- лимфоциты оказывают достаточно ограниченный терапевтический эффект. При этом те клетки, которые экспрессируют умеренное количество этого маркера, при обычной сортировке попадают либо в группу CD39-, либо к оверэкспрессирующим клеткам. В новой работе исследователи отсортировали полученные ранее CD8+ лимфоциты, разделив их на три группы: CD39low (экспрессирующие маркер CD39 в малых количествах), CD39med (среднеэкспрессирующие), и CD39high (оверэкспрессирующие). Первая группа клеток была слабо дифференцирована и почти не обладала цитотоксичностью, последняя наоборот, почти не обладала потенциалом к дифференцировке. Эти наблюдения согласовывались с уже имеющимися данными. Субпопуляция CD39med показывала и цитотоксичность, и умеренную способность к дифференцировке. Кроме того, у этой группы лимфоцитов сильнее всего экспрессировался маркер TCF7, который коррелирует с улучшением клинических результатов у пациентов.
Эффективность терапии с использованием разных субпопуляций проверили на мышиных моделях. Инъекция оверэкспрессирующей группы CD39high сначала показала высокую цитотоксичность, однако не смогла сдержать дальнейший рост опухоли спустя неделю после введения препарата. Группа CD39med продемонстрировала длительную противоопухолевую активность и повысила медианную выживаемость животных на 60% по сравнению с контрольной группой.
Наконец, ученые предположили, чем может объясняться повышенный терапевтический эффект субпопуляции CD39med. Возможно, дело в регуляторной роли, которую играет белок CD39 на внеклеточный метаболизм. CD39 — фермент, который превращает внеклеточный аденозинтрифосфат (АТФ) в аденозинмонофосфат (АМФ), который затем под действием других ферментов переходит в аденозин. Внеклеточный АТФ — сильный воспалительный сигнал, а аденозин обладает иммуносупрессирующими свойствами. Возможно, оверэкспрессия CD39 ограничивает иммунный ответ, повышая содержание аденозина в окружающей Т-клетки среде. В то же время высокая внеклеточная концентрация АТФ может быть токсичной для иммунных клеток, воздействуя на рецептор P2X7. Авторы исследования делают вывод, что баланс внеклеточного АТФ и аденозина важен для длительного сдерживания опухоли иммунными клетками.
Таким образом, исследователи предложили более эффективный и дешевый способ выделения субпопуляций опухоль-инфильтрирующих лимфоцитов для адоптивной иммунотерапии. Новый подход уменьшает стоимость лабораторного ведения и размножения лимфоцитов: для получения необходимого количества клеток в исследовании на мышиной модели ученым понадобилось всего пять дней, тогда как при сортировке FACS/МACS требуется 15. Ученые также отмечают, что предложенный ими метод может помочь в дальнейших исследованиях адоптивной иммунотерапии и поиске наиболее перспективных субпопуляций лимфоцитов.
Источник
Wang Z., et al. Efficient recovery of potent tumour-infiltrating lymphocytes through quantitative immunomagnetic cell sorting. // Nat Biomed Eng (2022), published 27 April 2022. DOI: 10.1038/s41551-021-00820-y


 Меню
Меню





 Все темы
Все темы




 0
0








