Новый способ доставки мРНК-вакцины против меланомы проверили на мышах
Разработан гидрогель из оксида графена и полиэтиленимина, в который можно загрузить мРНК и адъювант. После введения такого гидрогеля под кожу от него на протяжении длительного времени отделяются наночастицы с терапевтическими агентами, которые накапливаются в лимфоузлах. Там мРНК и адъювант активируют иммунную систему для борьбы с раком. Эффективность такого подхода была показана на мышах.
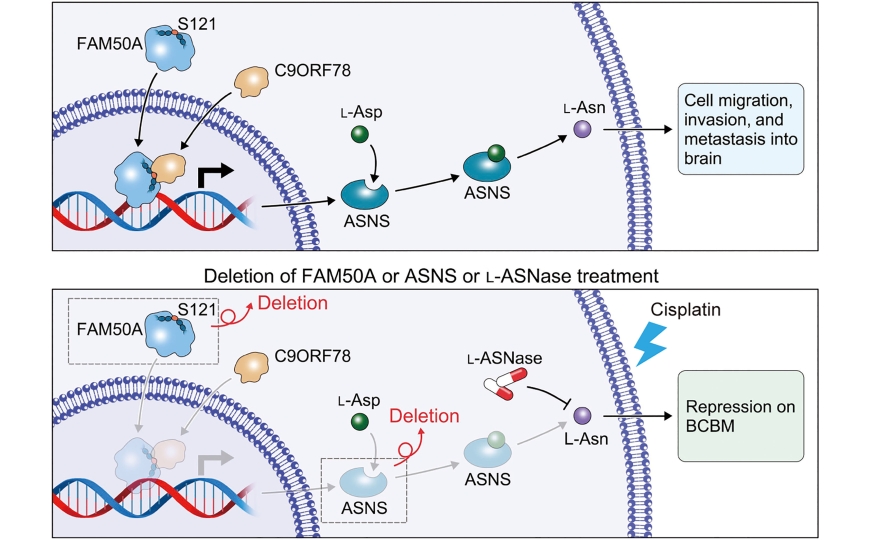
Создание вакцины, основанной на мРНК — очень привлекательная стратегия в иммунотерапии рака. К сожалению, мРНК нестабильна и плохо проникает внутрь клетки. Поэтому так много внимания уделяется разработке технологии, которая могла бы защитить мРНК и доставить её в нужную ткань для последующей трансляции. Ученые из Китая и Швеции разработали технологию доставки мРНК-вакцины в наночастицах, которые постепенно высвобождают мРНК-вакцину и адъювант в течение долгого времени.
В качестве адъюванта использовали резиквимод (R848); мРНК кодировала модельный белок овальбумин (mOVA). Оксид графена и низкомолекулярный полиэтиленимин смешивали для образования гидрогеля (GLP Gel). После этого R848 и mOVA инкапсулировали в гидрогеле (GLP-RO Gel). При приготовлении гидрогеля не образовывались ковалентные связи, поэтому в жидкости или в организме он был нестабилен и со временем формировал наночастицы (GLP-RO NP). При введении гидрогеля GLP-RO Gel под кожу он постепенно выпускал наночастицы GLP-RO NP, которые доставляли R848 и mOVA к лимфоузлам.
Ученые подтвердили способность наночастиц GLP-RO NP защищать инкапсулированную мРНК в течение 48 часов. В гидрогеле GLP-RO Gel мРНК хранилась по крайней мере десять дней, при этом она не деградировала.
С использованием флюоресцентной метки исследователи показали, что наночастицы проникают в антигенпрезентирующие клетки (например, RAW264.7 или DC2.4). Сначала наночастицы попадают в эндосомы/лизосомы, но было показано, что mOVA может проникать из лизосом в цитозоль. После этого с помощью вестерн-блота и иммуноферментного анализа подтвердили, что белок OVA экспрессируется в антигенпрезентирующих клетках. Наночастицы GLP-RO NP активировали DC2.4 клетки и увеличивали число CD86-положительных клеток, а главный комплекс гистосовместимости презентовал белок OVA.
Гидрогель GLP-RO Gel вводили под кожу мышам линии C57BL/6. Размер и масса введенного гидрогеля постепенно уменьшалась в течение по крайней мере 30 дней. К 30-му дню более чем 95% mOVA были высвобождены из гидрогеля.
Гидрогель обладал минимальной цитотоксичностью. Клетки мыши почти не проникали внутрь гидрогеля. Наночастицы GLP-RO NP накапливались в лимфоузлах и были замечены в печени, но не в сердце, легких, селезенке или почках.
Противоопухолевое действие наночастиц проверили на мышиной модели меланомы после имплантации опухолевых клеток B16-OVA. Гидрогель GLP-RO Gel ввели на четвертый день после имплантации. Через 22 дня после инъекции вакцины опухоли этих мышей были значительно меньше, чем у контролей. Некроз в их опухолях также был значительно повышен. Число CD8+ IFN-γ+ Т-клеток возросло, как и инфильтрация CD8+ клеток в опухоль, а уровень TNF-α повысился. Число OVA-специфичных антител также было значительно выше, чем у контролей, значит, гидрогель GLP-RO Gel может более эффективно предотвращать рецидивы и метастазирование. Действительно, метастазы в легких мышей после введения гидрогеля GLP-RO Gel отсутствовали.
Масса тела мышей, получивших гидрогель, не изменилась на 22-й день, и их внутренние органы не были повреждены, что подтверждало его безопасность для организма.
Авторы считают, что у их системы есть огромный потенциал для иммунотерапии рака.
Источник
Yin Y., et al. // In Situ Transforming RNA Nanovaccines from Polyethylenimine Functionalized Graphene Oxide Hydrogel for Durable Cancer Immunotherapy // Nano Lett. 2021, published online February 17, 2021, DOI: 10.1021/acs.nanolett.0c05039


 Меню
Меню





 Все темы
Все темы




 0
0