Обнаружен токсин, необходимый для роста легионеллы
Пневмония, вызванная бактериями рода Legionella, поражает всего одного на 100 000 европейцев, но среди заболевших риск смертности составляет 10%. Legionella pneumophila вырабатывает около 300 токсинов, помогающих ей заражать людей. Один из них оказался особенно важен.
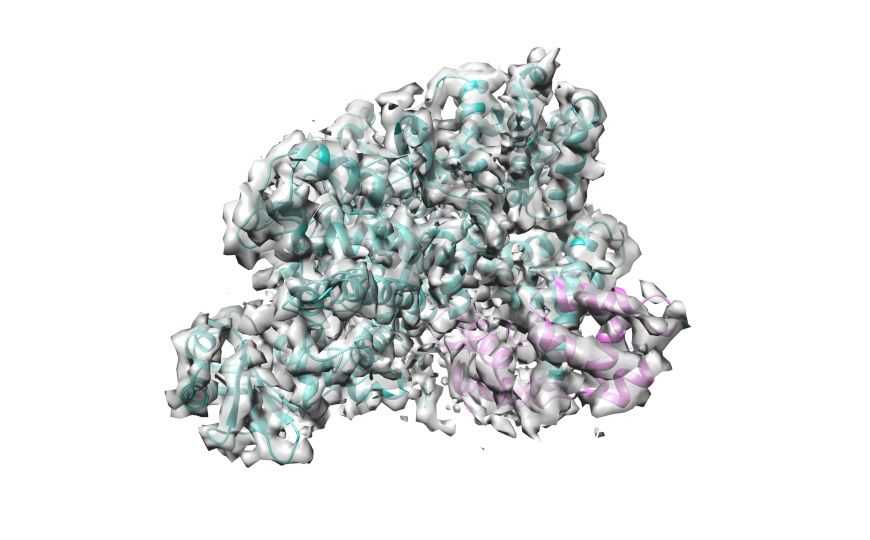
Структура комплекса токсина легионеллы SidJ с кальмодулином, полученная с помощью криоЭМ. SidJ показан бирюзовым, кальмодулин розовым.
Credit: EMBL | https://news.embl.de/science/legionella-toxin/
Большинство случаев заболевания легионеллезом сопровождается поражением легких. Легионеллы прикрепляются к рецепторам комплемента альвеолярных макрофагов нижних дыхательных путей, попадают к ним в вакуоли, где и размножаются. Токсины легионеллы целенаправленно нарушают работу врожденного иммунитета, облегчая выживание и размножение бактерий в организме человека. Этих токсинов очень много, и некоторые из них выполняют сходные функции, поэтому непросто найти те, что играют ключевую роль в распространении инфекции и нацелить лечение именно на них.
Исследователи из Европейской лаборатории молекулярной биологии (Гренобль) и университета Гёте (Франкфурт) решили сконцентрироваться на токсине SidJ. Делеция гена SidJ ведет к значительным нарушениям роста популяции бактерий, причем как в клетках амебы, ее природного хозяина, так и в макрофагах мышей.
SidJ изучают уже более 10 лет, но его функция не была известна до сих пор. «Нам пришлось обратиться к стандартным биохимическим методам и масс-спектрометрии, чтобы определить его функцию, — рассказал Сагар Бхогараджу из Университета Гете, первый автор статьи. — Механизм его работы также оказался очень сложным и интересным». В новой статье подробно описана молекулярная функция этого токсина, его важность для легионеллы и белки человеческого организма, на которые он воздействует.
Оказалось, что SidJ может присоединять глутамат к белку-мишени в качестве посттрансляционной модификации. «Эта способность очень важна для бактериальных белков», — сказал Иван Чикич, директор кафедры биохимии в университете Гёте. SidJ опосредует глутамилирование бактериальных регуляторных белков — семейства убиквитинлигаз SidE. Эти белки находятся на поверхности вакуолей с легионеллами и присоединяют убиквитин к белкам хозяина. В частности, SidJ модифицирует каталитический домен одного из белков семейства, SdeA, блокируя его активность. Возможно, замедляя действие SidE, SidJ продлевает жизнь клетки-хозяина, что в итоге способствует развитию инфекции.
Важно, что перед глутамилированием SidJ взаимодействует с кальмодулином, консервативным многофункциональным Ca2+-зависимым белком-мессенджером. «Легионелла научилась хитроумно использовать кальмодулин для активации SidJ. Это не дает токсину начать работать до того, как инфекция попадет в организм человека», — объяснил Чикич.
Кроме того, методы количественной протеомики выявили множество белков хозяина, которые могут быть мишенями глутамилирования, опосредованного SidJ.
Криоэлектронная микроскопия обнаружила у SidJ киназный домен — участок, общий для всех ферментов, присоединяющих к белкам фосфатную группу. Это важно, поскольку на киназный домен можно воздействовать лекарствами.
Сходные результаты получили авторы работы, опубликованной в Science в мае 2019 года.
В дальнейшем механизм работы SidJ будет исследован более подробно. «У нашей работы нет прямого фармацевтического применения, но полученная нами информация о структурно-функциональных характеристиках одного из важнейших токсинов легионеллы поможет будущим исследователям целенаправленно влиять на SidJ в терапевтических целях», — считает Сагар Бхогараджу.
Источники
Sagar Bhogaraju, et al. // Inhibition of bacterial ubiquitin ligases by SidJ–calmodulin-catalysed glutamylation// Nature, 2019; DOI: 10.1038/s41586-019-1440-8
Цитаты по пресс-релизу

 Меню
Меню





 Все темы
Все темы




 0
0