Однократное введение малой молекулы уничтожило опухоли молочной железы у мышей
Ученые из США разработали препарат, который устранял или значительно уменьшал опухоли молочной железы даже при однократном введении — пока что его протестировали на мышах. Соединение специфично к ER-положительным клеткам рака молочной железы; оно вызывает быструю некротическую гибель клеток-мишеней без участия иммунной системы и эффективно в том числе при лекарственно-устойчивых видах рака. Препарат показал хорошую переносимость, что в сочетании со сравнительно быстрым действием может значительно повысить качество жизни пациентов.
Рак молочной железы (РМЖ) занимает второе место среди причин смертности от онкологических заболеваний у женщин. Примерно 70% случаев связаны с ER-положительными (ERα+) опухолями, рост которых стимулируется эстрогеном. Стандартное лечение таких опухолей включает хирургическое вмешательство и длительную гормональную терапию для подавления действия эстрогена. Однако ежедневный прием препаратов в течение 5–10 лет нередко сопровождается побочными эффектами, такими как остеопороз, тромбоз и половая дисфункция, что снижает приверженность пациенток к лечению и увеличивает риск рецидива. Кроме того, в ряде случаев рак устойчив к гормональной терапии. Из-за этого необходимо разрабатывать новые, более эффективные и менее токсичные методы лечения. Именно этой проблемой занялись ученые из США, которые создали и протестировали на мышах противоопухолевую малую молекулу. Однократное введение нового препарата практически полностью устраняло ERα+ опухоли у животных.
Препарат основан на более ранней разработке этого же коллектива — соединении ErSO из класса 3-(4-гидроксифенил)индолин-2-онов. Оно нарушает катионный баланс в раковых клетках, приводя к некрозу. Оптимизировав молекулу, ученые получили ErSO-TFPy — более селективный аналог, который обладает лучшей переносимостью и более высокой противоопухолевой активностью.
Механизм действия ErSO-TFPy авторы изучали in vitro на клеточных линиях ERα+ рака молочной железы человека. Препарат вызывал быстрое набухание и некротическую гибель раковых клеток. Его цитотоксическая активность зависела от экспрессии рецепторов эстрогена — она оказалась высокой для ERα+-клеток и значительно ниже для ERα–-клеточных линий. Ключевым для действия ErSO-TFPy был кальций-активируемый натриевый канал TRPM4 — удаление его гена снижало чувствительность клеток к препарату более чем в 1 000 раз.
Исследования также показали, что ErSO-TFPy активирует превентивный ответ на несвернутые белки (a-UPR), который усиливает гибель раковых клеток. Препарат действует быстро: всего двух часов инкубации с ним достаточно для индукции некроза, что выгодно отличает его от других препаратов, требующих длительного воздействия.
Дальнейшие эксперименты проводили на клетках ERα+ рака молочной железы с мутациями в рецепторе эстрогена или без них. В отличие от таких препаратов, как фулвестрант, амценстрант, камизестрант (антагонисты эстрогеновых рецепторов) и капасертиб (ингибитор AKT), которые проявляли эффект через 120 часов и только в средах без эстрогенов, ErSO-TFPy вызывал интенсивную гибель клеток, а не просто замедлял их рост.
Препарат хорошо переносился мышами, крысами и собаками, в том числе при внутривенном введении высоких доз. Выраженных побочных эффектов не отмечалось. Эксперименты на мышах подтвердили высокую эффективность ErSO-TFPy. Мышам с ксенотрансплантатами опухолей (им подсаживали клетки MCF-7) вводили препарат внутривенно раз в неделю (всего 4 дозы). Дозировка 5 мг/кг ингибировала рост опухоли, а при 10 мг/кг достигалась полная регрессия. ErSO-TFPy также продемонстрировал эффективность против лекарственно-резистентной опухоли, полученной от пациента: дважды в неделю мышам вводили препарат, и за месяц такая терапия, в отличие от фулвестранта, приводила к исчезновению опухоли.
Даже однократное введение препарата вызывало значительную регрессию опухолей (в том числе крупных — объемом 500–1500 мм³). Этот эффект сохранялся в различных моделях рака молочной железы, включая устойчивые к гормональной терапии. Удивительно, но регрессия опухолей продолжалась даже после выведения препарата из организма. Ученые установили, что это связано с быстрой некротической гибелью раковых клеток, не зависящей от активации иммунной системы.
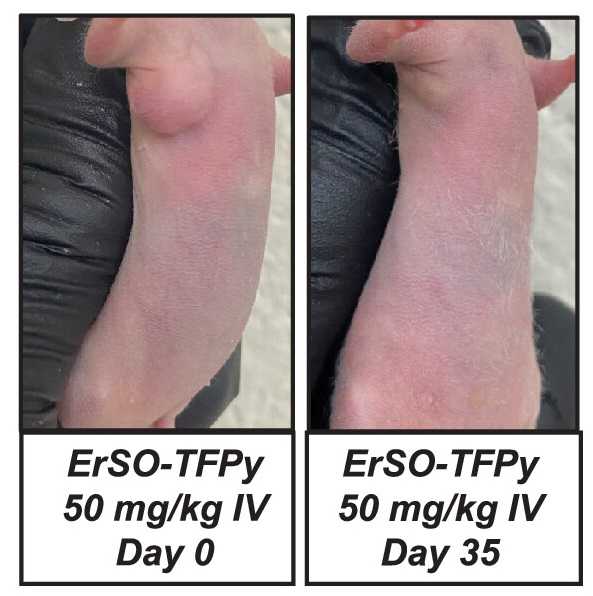 У мыши, которой один раз ввели 50 мг/кг ErSO-TFPy, за 35 дней практически полностью исчезла подсаженная опухоль.
У мыши, которой один раз ввели 50 мг/кг ErSO-TFPy, за 35 дней практически полностью исчезла подсаженная опухоль.Credit:
ACS Cent. Sci (2025). DOI: 10.1021/acscentsci.4c01628 | CC BY
Некроз клеток начинался через несколько часов после введения препарата, что выгодно отличает ErSO-TFPy от других противораковых средств, требующих длительного воздействия. У мышей с опухолями MCF-7, несущими мутацию в рецепторе эстрогена, через 3–5 дней после введения однократной дозы 50 мг/кг наблюдалось сокращение объема опухолей более чем на 90% за счет некротической гибели клеток. При этом происходили также снижение пролиферации и активация апоптоза.
Анализ показал, что некротическая гибель клеток не зависит от иммунного ответа. Иммунные клетки, такие как нейтрофилы и дендритные клетки, не играют значимой роли на ранних этапах, тогда как макрофаги участвуют в фагоцитозе некротических клеток на более поздних стадиях (день 3–5).
Основным ограничением исследования является то, что эффективность ErSO-TFPy изучалась преимущественно на иммунодефицитных мышах. Это подчеркивает необходимость дополнительных исследований, направленных на оценку роли иммунной системы в ответе на препарат, особенно учитывая, что некроз клеток может провоцировать иммунный ответ. Для внедрения ErSO-TFPy в клиническую практику потребуется дальнейшая оценка токсичности на животных и проведение клинических испытаний на людях.
В доклинических исследованиях часто используются опухоли размером 100–200 мм³, и даже в этих условиях их полная регрессия при использовании малых молекул встречается крайне редко и обычно требует многократного введения. ErSO-TFPy же показал высокую эффективность при минимальном вмешательстве наряду с хорошей переносимостью, что делает его перспективным для клинического применения. Более того, его механизм действия может способствовать разработке терапии других видов рака с повышенной экспрессией TRPM4.
Камрелизумаб повысил эффективность химиотерапии при трижды негативном РМЖ
Источник
Mulligan, M. P et al. Single Dose of a Small Molecule Leads to Complete Regressions of Large Breast Tumors in Mice. // ACS Cent. Sci (2025), published online 22 January 2025. DOI: 10.1021/acscentsci.4c01628


 Меню
Меню





 Все темы
Все темы




 0
0








