Описан новый тип дистрофии сетчатки, ассоциированный с мутациями в гене Timp3
Американские ученые обследовали пациентов с макулодистрофией, вызванной мутациями в гене Timp3, но без типичных для таких мутаций симптомов дистрофии глазного дна Сорсби. Оказалось, что в этом случае патогенез ассоциирован с иным механизмом — нарушением транспорта кодируемого белка в межклеточный матрикс.
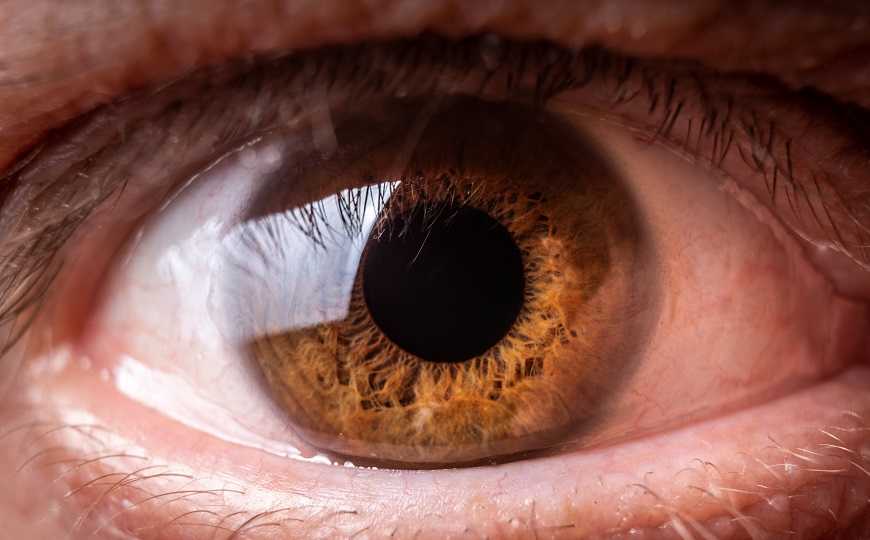
Для макулодистрофии характерно поражение сетчатки и потеря центрального зрения. Развитие патологии обусловлено мутациями в генах Abca4, Best1, Prph2, Timp3 и других. В частности, варианты в гене Timp3 ассоциированы с дистрофией глазного дна Сорсби. Эта разновидность макулодистрофии проявляется во взрослом возрасте и сопровождается атрофией пигментного эпителия сетчатки на фоне неоваскуляризации хориоидеи — прорастания сосудов через пигментный слой к нижележащим слоям сетчатки.
Однако исследователи из Национального института глаз (США) сообщили о пациентах с макулодистрофией, связанной с мутациями в гене Timp3, но с более ранним началом и без следов неоваскуляризации сетчатки.
Специалисты института наблюдали за состоянием глаз и зрения у членов семей К257 и К392 (два и четыре человека соответственно) с 2009 по 2021 год. Пациенты прошли генетическое тестирование на наличие мутаций, ассоциированных с дистрофией сетчатки.
У всех пациентов выявили пятна атрофии в пигментном эпителии. Обширная дегенерация затронула макулу — участок с наибольшей концентрацией колбочек. Патологические изменения характеризовались ранним началом и привели к развитию скотом, то есть выпадения из поля зрения целых участков. При этом у пациентов сохранялось центральное зрение и не было признаков неоваскуляризации, как в типичном случае дистрофии глазного дна Сорсби.
Анализ геномов пациентов выявил мутации в гене Timp3, которые отразились на строении N-конца кодируемого белка. Так, в семье К257 произошла замена лейцина на гистидин в десятом положении, а в семье К392 – глицина на аргинин в положении 12.
Нестандартная симптоматика дистрофии сетчатки в сочетании с мутациями гена Timp3 в исследуемых семьях подтолкнула ученых к гипотезе, что два генетических варианта связаны с иным патофизиологическим механизмом: через нарушение транспорта кодируемого белка в межклеточный матрикс.
Предположение проверили в экспериментах in vitro на клеточной линии HEK293. Экспрессия мутантной формы белка привела к снижению клетками секреции TIMP3 в межклеточный матрикс по сравнению с контрольными клетками дикого типа. Вероятно, избыточное накопление TIMP3 было токсичным для клеток. Причина замедления секреции крылась в нарушении отщепления сигнального пептида.
По мнению исследователей, открытие новых механизмов заболевания, обусловленных мутациями даже в известных генах, может помочь в постановке верного диагноза, а также в коррекции методов лечения.
Источник
Bin Guan, et al. Early-Onset TIMP3-Related Retinopathy Associated With Impaired Signal Peptide. // JAMA Ophthalmology, 2022, published online 9 June 2022. DOI: 10.1001/jamaophthalmol.2022.1822


 Меню
Меню





 Все темы
Все темы




 0
0