Органоиды глиобластомы из клеток пациента точно моделируют ответ на терапию
Бивалентные CAR T-клетки, нацеленные на EGFR и IL13Rα2, в этом году показали многообещающие результаты у пациентов с глиобластомой в фазе 1 клинических исследований. Однако оценить ответ пациента и эффективность терапии на гистологическом и клеточном уровне затруднительно, поскольку регулярно брать биопсию мозга невозможно. Исследователи из США предложили использовать для этого органоиды, полученные из опухолевой ткани, и показали, что такая модель достоверно отражает динамику активации CAR T-клеток в организме пациента и эффективность их атаки на опухоль.
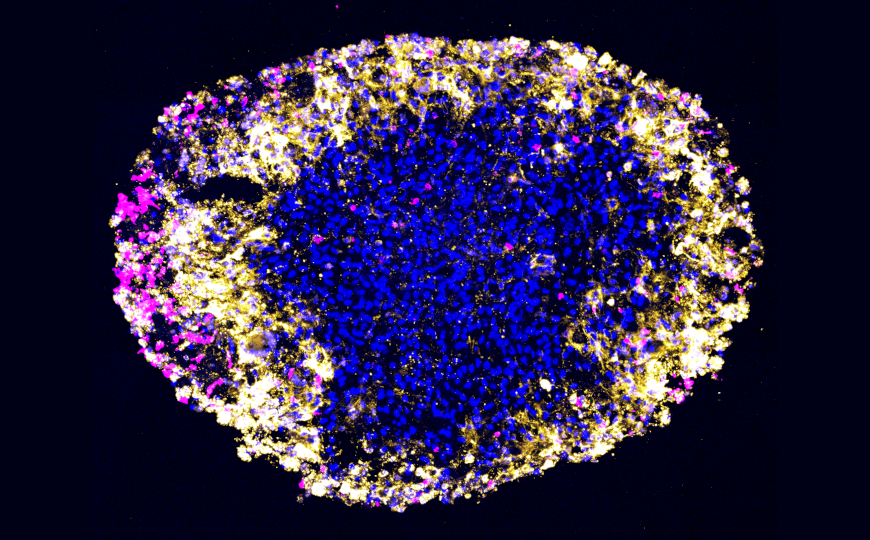
Органоид глиобластомы: CAR T-лимфоциты (пурпурные) проникают в ткань и атакуют опухолевые (синие) клетки. Желтым окрашены погибающие клетки опухоли.
Credit:
Image by Yusha Sun and Xin Wang from the laboratories of Guo-li Ming and Hongjun Song |
пресс-релиз
Глиобластома — наиболее распространенная первичная опухоль головного мозга у взрослых. Этот вид рака остается маловосприимчивым как к стандартным методам лечения, так и к новым разрабатываемым терапиям, из-за чего выживаемость пациентов обычно не превышает двух лет. При этом гетерогенность опухоли препятствует тому, чтобы предсказать ответ пациента на ту или иную терапию. «Трудно определить, как пациент с глиобластомой реагирует на лечение, потому что мы не можем регулярно делать биопсию мозга, а на МРТ сложно отличить рост опухоли от воспаления, вызванного лечением», — объясняет профессор неврологии Хунцзюнь Сун, один из главных авторов статьи в Cell Stem Cell. Вместе с коллегами он предложил метод решения этой проблемы — органоиды глиобластомы, полученные из клеток пациента и позволяющие моделировать реакцию на лечение.
Выбор органоидов, а не клеточной культуры или животной модели ксенотрансплантата, обусловлен тем, что органоиды достаточно точно отражают гистологические характеристики опухоли (в отличие от монослоя клеток) и вместе с тем культивируются гораздо быстрее, чем растет полученный от пациента образец опухоли в модельном животном. Исследователи проверили подход на CAR T-терапии глиобластомы — перспективном методе иммунотерапии, который, однако, тяжело быстро протестировать в иных условиях.
Образцы глиобластомы получили от пациентов с рецидивирующей глиобластомой, участвовавших в фазе 1 клинического исследования — биопсию брали в ходе хирургического удаления основной опухолевой массы за 2-4 недели до иммунотерапии. Тестируемые CAR T-клетки были нацелены на EGFR и IL13Rα2. Их вводили пациентам под твердую мозговую оболочку.
Все опухолевые образцы сформировали органоиды за 2-3 недели культивирования. Иммуноокрашивание подтвердило присутствие обоих мишеней CAR в органоидах, причем уровень экспрессии был сопоставим с исходным, измеренным на первичном образце опухолевой ткани. После этого аутологичные CAR T-клетки культивировали вместе с органоидами в течение шести дней. Цитотоксическое воздействие на опухолевые клетки оценивали, измеряя, как меняется импеданс (комплексное электрическое сопротивление) в органоиде. Лизис клеток также подтверждали иммуноокрашиванием на расщепленную форму каспазы-3 — маркер апоптоза. Оба метода показали, что CAR T активно убивали опухолевые клетки, причем максимальная интенсивность цитолиза в первые 24 часа эксперимента напрямую коррелировала с приживлением введенных пациентам клеток в этот же период (чтобы это определить, исследователи оценивали их количество в спинномозговой жидкости).
Через шесть суток культивирования ex vivo терапевтические клетки заметно снизили экспрессию обеих мишеней в опухолевых органоидах. Преимущественно они атаковали клетки, несущие одновременно EGFR и IL13Rα2, причем в первую очередь нацеливались на EGFR. Эту динамику ученые также определили с помощью иммуноокрашивания органоидов.
Иммуноферментный анализ культуральной жидкости, в которой содержали органоиды и CAR T-клетки, выявил активацию последних — клетки выделяли цитокины IFN-γ, TNFα и IL-2. Пик активации приходился на вторые-третьи сутки.
Уровни цитокинов были сопоставимы в среде и в спинномозговой жидкости пациентов. Совпадала также временная динамика, измеренная для каждой пары «пациент — органоид его опухоли». Кроме того, количества цитокинов в культуральной жидкости соотносились с кинетикой активации CAR T-клеток в организме пациентов, которую также оценивали в ходе клинического испытания.
«Эти органоиды с большой точностью отражают происходящее в мозге человека, и мы надеемся, что в будущем их можно будет использовать для “знакомства” с опухолью каждого пациента и быстрого определения наиболее эффективных методов лечения в рамках персонализированной медицины», — подытоживает Хунцзюнь Сун.
Источник
Meghan Logun, et al. Patient-derived glioblastoma organoids as real-time avatars for assessing responses to clinical CAR-T cell therapy. // Cell Stem Cell, 2024. DOI: 10.1016/j.stem.2024.11.010
Цитата по пресс-релизу


 Меню
Меню





 Все темы
Все темы




 0
0







